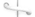|
||||||||||||||||
|
||||||||||||||||
|
||||||||||||||||
.
浏览目录
《化工基础》模拟试卷(三)参考答案
一、 选择题
1D、2A、3C、4A、5B、6A、7D、8C、9B、
10B、11D、12C、13B、14C、15A
二、 简答题
1. 孔板流量计的结构如图所示
1 2
R
1、 2两截面处列柏努利方程(忽略阻力损失),则有:
用u0代替u2,并加入校正常数C, 得
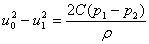
又因为
,则有:
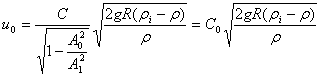
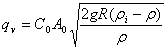
2. 图解描述如下
操作线,斜率=L/G(液气比)
Y1
Y 斜率=(L/G)min(最小液气比)
平衡线
Y2
X2 X1 X1,max
X 最大出塔吸收液浓度
3. 由公式
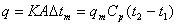
知:当q 不变时,t2升高,qm必减小,操作费减少,但t2升高,Dtm必减小,A(换热面积)必增加,设备费增加。因此,冷流体出口温度的选择必须兼顾上述两个因素,选择一个总费用最低的t2。
总费用
费用 设备费
操作费
t2,opt
t2
三、 计算题
列粗管口到细管口的柏努利方程
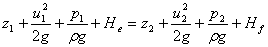
依题意
u1=0,u2=7.5m,p1=250kPa,p2=100kPa,
u1=(d1/d2)2u2=4/9u2,Hf=5m,He=0
将上述数据代入柏努利方程,可求得
u2=8.26m/s
四、 计算题
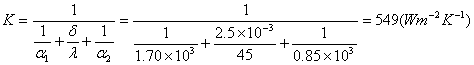
(0C)
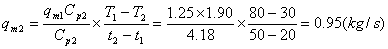
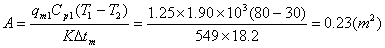
五、 计算题
,
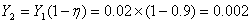
(1).
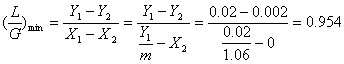
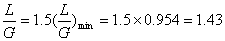
L=1.43G=1.43´100=143kmol/h
(2).
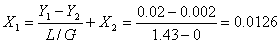
(3).
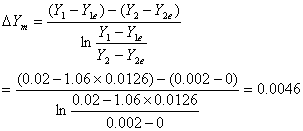
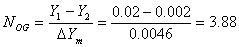
六、 计算题
醋酸(A)投料体积:VA = 60 / 960 = 0.0625 m3,
丁醇(B)投料体积:VB = (74×4.96) / 740 = 0.496 m3,
反应总体积VR = VA + VB = 0.559 m3。
CA0 = NA0 / VR = 1 / 0.559 = 1.79 k mol / m3
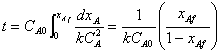
转化率为0.5时:
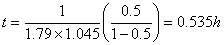
转化率为0.9时:
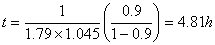
七、 讨论题
合成氨的工艺流程
(1)原料气制备 将煤和天然气等原料制成含氢和氮的粗原料气。对于固体原料煤和焦炭,通常采用气化的方法制取合成气;渣油可采用非催化部分氧化的方法获得合成气;对气态烃类和石脑油,工业中利用二段蒸汽转化法制取合成气。
(2)净化 对粗原料气进行净化处理,除去氢气和氮气以外的杂质,主要包括变换过程、脱硫脱碳过程以及气体精制过程。
① 一氧化碳变换过程
在合成氨生产中,各种方法制取的原料气都含有CO,其体积分数一般为12%~40%。合成氨需要的两种组分是H2和N2,因此需要除去合成气中的CO。变换反应如下:
CO+H2O→H2+CO2
由于CO变换过程是强放热过程,必须分段进行以利于回收反应热,并控制变换段出口残余CO含量。第一步是高温变换,使大部分CO转变为CO2和H2;第二步是低温变换,将CO含量降至0.3%左右。因此,CO变换反应既是原料气制造的继续,又是净化的过程,为后续脱碳过程创造条件。
② 脱硫脱碳过程
各种原料制取的粗原料气,都含有一些硫和碳的氧化物,为了防止合成氨生产过程催化剂的中毒,必须在氨合成工序前加以脱除,以天然气为原料的蒸汽转化法,第一道工序是脱硫,用以保护转化催化剂,以重油和煤为原料的部分氧化法,根据一氧化碳变换是否采用耐硫的催化剂而确定脱硫的位置。工业脱硫方法种类很多,通常是采用物理或化学吸收的方法,常用的有低温甲醇洗法(Rectisol)等。
粗原料气经CO变换以后,变换气中除H2外,还有CO2、CO和CH4等组分,其中以CO2含量最多。CO2既是氨合成催化剂的毒物,又是制造尿素、碳酸氢铵等氮肥的重要原料。因此变换气中CO2的脱除必须兼顾这两方面的要求。
一般采用溶液吸收法脱除CO2。根据吸收剂性能的不同,可分为两大类。一类是物理吸收法,如低温甲醇洗法(Rectisol)法。一类是化学吸收法,如热钾碱法,低热耗本菲尔法,活化MDEA法,MEA法等。
③ 气体精制过程
经CO变换和CO2脱除后的原料气中尚含有少量残余的CO和CO2。为了防止对氨合成催化剂的毒害,规定CO和CO2总含量不得大于10cm3/m3(体积分数)。因此,原料气在进入合成工序前,必须进行原料气的最终净化,即精制过程。
目前在工业生产中,最终净化方法分为深冷分离法和甲烷化法。深冷分离法主要是液氮洗法,是在深度冷冻(<-100℃)条件下用液氮吸收分离少量CO,而且也能脱除甲烷和大部分氩,这样可以获得只含有惰性气体100cm3/m3以下的氢氮混合气,深冷净化法通常与空分以及低温甲醇洗结合。甲烷化法是在催化剂存在下使少量CO、CO2与H2反应生成CH4和H2O的一种净化工艺,要求入口原料气中碳的氧化物含量(体积分数)一般应小于0.7%。甲烷化法可以将气体中碳的氧化物(CO+CO2)含量脱除到10cm3/m3以下,但是需要消耗有效成分H2,并且增加了惰性气体CH4的含量。甲烷化反应如下:
CO+3H2→CH4+H2OCO2+4H2→CH4+2H2O
(3)氨合成 将纯净的氢、氮混合气压缩到高压,在催化剂的作用下合成氨。氨的合成是提供液氨产品的工序,是整个合成氨生产过程的核心部分。氨合成反应在较高压力和催化剂存在的条件下进行,由于反应后气体中氨含量不高,一般只有10%~20%,故采用未反应氢氮气循环的流程。氨合成反应式如下:
N2+3H2→2NH3(g)