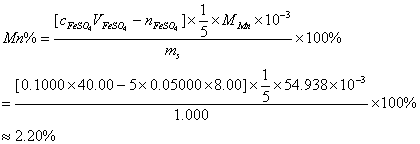分析化学 试题( D )标准答案
班级 姓名: 学号 分数
一、选择题(共 20 分,每小题 1 分)
1 .可用于减小测定过程中偶然误差的方法是( D )。
A .对照实验 B. 空白实验
C .校正仪器 D. 增加平行测定次数
2 . Sr 3 (PO 4 ) 2 的溶解度为 1.0×10 -6 mol/L ,则其 K sp 值为( C )。
A . 1.0×10 -30 B . 5.0×10 -29
C . 1.1×10 -28 D . 1.0×10 -12
3 .影响氧化还原反应平衡常数的因素是( B )。
A. 反应物浓度 B. 温度
C. 催化剂 D. 反应产物浓度
4 .测定 Ag + 含量时,选用( C )标准溶液作滴定剂。
A. NaCl B. AgNO 3
C. NH 4 SCN D. Na 2 SO 4
5 . EDTA 滴定 Zn 2+ 时,加入 NH 3 — NH 4 Cl 可( B )。
A. 防止干扰 B. 防止 Zn 2+ 水解
C. 使金属离子指示剂变色更敏锐 D. 加大反应速度
6 .用 H 2 C 2 O 4 · 2H 2 O 标定 KMnO 4 溶液时,溶液的温度一般不超过( D ),以防 H 2 C 2 O 4 的分解。
A. 60 ° C B. 75 ° C
C. 40 ° C D. 85 ° C
7 .对某试样进行平行三次测定,得 CaO 平均含量为 30.60% ,而真实含量为 30.30% ,则 30.60%-30.30% = 0.30% 为( B )。
A. 相对误差 B. 绝对误差
C. 相对偏差 D. 绝对偏差
8 .下列阴离子的水溶液,若浓度相同,则( B )碱度最强。
A. CN - ( K CN - = 6.2 ′ 10 -10 ) B. S 2- (K HS - = 7.1 ′ 10 -15 , K H2S =1.3 ′ 10 -7 )
C. F - (K HF = 3.5 ′ 10 -4 ) D. CH 3 COO - (K HAc = 1.8 ′ 10 -5 )
9 .在纯水中加入一些酸,则溶液中( C )。
A. [H + ][OH - ] 的乘积增大 B. [H + ][OH - ] 的乘积减小
C. [H + ][OH - ] 的乘积不变 D. 水的质子自递常数增加
10 .示差分光光度法适用于( B )。
A. 低含量组分测定 B. 高含量组分测定
C. 干扰组分测定 D. 高酸度条件下组分测定
11 .在液 - 液萃取中,同一物质的分配系数与分配比不同,这是由于物质在两相中的( D )。
A. 浓度 B. 溶解度不同
C. 交换力不同 D. 存在形式不同
12 .若以反应物的化学式为物质的基本单元,则( A )。
A. 各反应物的物质的量应成简单的整数比
B. 各反应物的物质的量应等于相应物质的质量之比
C. 各反应物的物质的量之比应等于相应物质的摩尔质量之比
D. 各反应物的物质的量应相等
13 .用纯水将下列溶液稀释 10 倍,其中 pH 值变化最大的是( A )。
A. 0.1 mol/L HCl B. 0.1 mol/L HAc
C. 1 mol/L NH 3 · H 2 O D. 1 mol/L HAc + 1 mol/L NaAc
14 .用 BaSO 4 重量法测定 Ba 2+ 的含量,较好的介质是( C )。
A. 稀 HNO 3 B. 稀 HCl
C. 稀 H 2 SO 4 D. 稀 HAc
15 .电极电位对判断氧化还原反应的性质很有用,但它不能判断( B )。
A. 氧化还原反应的完全程度 B. 氧化还原反应速率
C. 氧化还原反应的方向 D. 氧化还原能力的大小
16 .用同一 KMnO 4 标准溶液分别滴定等体积的 FeSO 4 和 H 2 C 2 O 4 溶液,消耗等体积的标准溶液,则 FeSO 4 与 H 2 C 2 O 4 两种溶液的浓度之间的关系为( A )。
A. 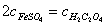 B.
B. 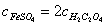
C.  D.
D. 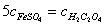
17 .若 A - 为强酸根,存在可与金属离子形成络合物的试剂 L ,则难溶化合物 MA 在水中溶解度为( B )。
A. 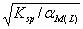 B.
B. 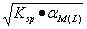
C. 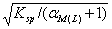 D.
D. 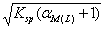
18 .萃取过程的本质为( D )。
• 金属离子形成螯合物的过程
• 金属离子形成离子缔合物的过程
C. 络合物进入有机相的过程
D. 待分离物质由亲水性转变为疏水性的过程
19 .以下物质能作为基准物质的是( D )。
• 优质纯的 NaOH B. 100 ℃干燥过的 CaO
C. 光谱纯的 Co 2 O 3 D. 99.99% 纯锌
20 .如果分析结果要求达到 0.1% 的准确度,使用灵敏度为 0.1 mg 的分析天平称取样品,至少应称取( B )。
A. 0.1 g B. 0.2 g
C. 0.05 g D. 0.5g
二、判断题(共 20 分,每小题 1 分,正确划√,错误划×)
1 .间接碘量法测定铜时,在 HAc 介质中反应: 2Cu 2+ + 4I - → 2CuI ↓ + I 2 之所以能够定量完成,主要原因是由于过量 I - 使 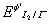 减小了( × )。
减小了( × )。
2 .对某项测定来说,它的系统误差大小是不可测量的( × )。
3 . KH 2 PO 4 水溶液的质子条件为 :[H + ]+[H 3 PO 4 ] = [H 2 PO 4 - ] + [HPO 4 2- ] + 2[PO 4 3- ] + [OH - ] ( × )。
4 .分析结果的置信度要求越高 , 置信区间越小( × )。
5 . NaHCO 3 中含有氢,故其水溶液呈酸性( × )。
6 .酸碱指示剂本身必须是有机弱酸或弱碱( √ )。
7 .络合滴定曲线描述了滴定过程中溶液 pH 变化的规律性( × )。
8 .沉淀的沉淀形式和称量形式既可相同,也可不同( √ )。
9 .缓冲溶液是由某一种弱酸或弱碱的共轭酸碱对组成的( √ )。
10 .根据同离子效应,可加入大量沉淀剂以降低沉淀在水中的溶解度( × )。
11 .金属离子指示剂与金属离子生成的络合物过于稳定称为指示剂的僵化现象( × )。
12 .在吸光光度法中,有色溶液稀释可使显色溶液的波长改变,但摩尔吸光系数不变( × )。
13 .氧化还原滴定中,化学计量点时的电位是由氧化剂和还原剂的标准电极电位的决定的( × )。
14 .有效数字是指所用仪器可以显示的数字( × )。
15 .在重量分析法中,沉淀的颗粒度愈大,沉淀的溶解度愈大( × )。
16 .根据酸碱质子理论,在水溶液中能够电离出质子的物质称为酸( × )。
17 .化学分析法准确度高,吸光光度法灵敏度高( √ )。
18 .络合滴定中,溶液的最佳酸度范围是由 EDTA 决定的( × )。
19 .吸光光度法中溶液透光率与待测物质的浓度成正比( × )。
20 .用莫尔法可以测定 Cl - 、 Br - 和 I - ( × )。
三、简答题(共 10 分,每小题 5 分)
• 可用哪些方法测定 Ca 2+ ?试写出化学反应方程式,并注明反应条件。
答:
• 酸碱滴定法: Ca 2+ → CaCO 3 → Ca 2+ ( 加入过量 HCl) ,以酚酞为指示剂,用 NaOH 标准溶液滴定过量 HCl 。
• 络合滴法: Ca 2+ + H 2 Y 2- → CaY 2- + 2H + ,在 pH~10 时,以铬黑 T 为指示剂,用 EDTA 直接滴定 Ca 2+ 。
• 氧化还原滴定法: Ca 2+ → CaC 2 O 4 → Ca 2+ (加入强酸) + H 2 C 2 O 4 ,用 KMnO 4 滴定 H 2 C 2 O 4 来间接测量 Ca 2+
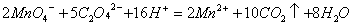
• 重量分析法: Ca 2+ → CaC 2 O 4 ↓,经过滤、洗涤、干燥,用天平称量 CaC 2 O 4 ,再换算为 Ca 2+ 。
• 简述滴定分析法对化学反应的要求?
答:
• 反应必须具有确定的化学计量关系。
• 反应必须定量地进行。
• 必须具有较快的反应速度。
• 必须有适当简便的方法确定滴定终点。
四、计算题(共 20 分,每小题 10 分)
1. 计算 CaC 2 O 4 在 pH = 5.0 的 0.010 mol/L 草酸溶液中的溶解度 (H 2 C 2 O 4 : 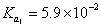 ,
, 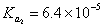 ; CaC 2 O 4 :
; CaC 2 O 4 :  ) 。
) 。
解: pH = 5.0 , [H + ]=10 -5 ,设 CaC 2 O 4 的溶解度为 s,
则 [Ca 2+ ] = s ,溶液中 [C 2 O 4 2- ] 来自两部分,一部分来自 H 2 C 2 O 4 解离,一部分来自 CaC 2 O 4 解离。
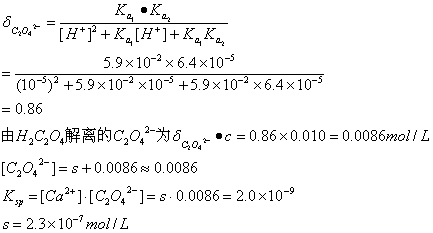
2. 含有锰的样品 1.000 g ,经预处理为含 MnO 4 - 的溶液,加入 40.00 ml FeSO 4 标准溶液,过量的 FeSO 4 溶液用 0.05000 mol/L KMnO 4 标准溶液滴定,消耗 8.00ml 。 已知 1 ml FeSO 4 标准溶液相当于 1ml 滴定度为 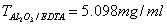 EDTA, 试计算样品中 Mn 的质量分数 (Al 2 O 3 : 101.96 , Mn : 54.938) 。
EDTA, 试计算样品中 Mn 的质量分数 (Al 2 O 3 : 101.96 , Mn : 54.938) 。
解: 1 )求 FeSO 4 标准溶液的量浓度
根据滴定度的定义: Al 2 O 3 ~ 2Al 3+ ~ 2EDTA
1mol 2mol
 c EDTA · V EDTA
c EDTA · V EDTA
所以, c EDTA = 0.1000mol/L , 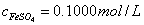
2 )求 Mn 含量:样品中 Mn ~ KMnO 4
KMnO 4 ~ 5FeSO 4
1mol/L 5mol/L
0.050000×8.00 
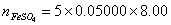 mmol
mmol