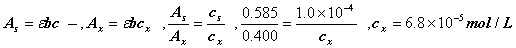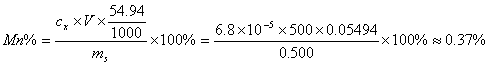分析化学试题( A )标准答案
班级 姓名: 学号 分数
一、单项选择(在四个答案中,选一正确的答案将其序号填在( )内,每小题 1 分,共 20 分)
1. b 2. c 3. b 4. c 5. b 6. c 7. d 8. b 9. c 10. b
11. b 12. b 13. c 14. b 15. b 16. a 17. d 18. c 19. d 20. b
二、判断(每小题 2 分,共 20 分,正确的在( )内  打“ √ ”,错误的在( )内打“ ╳ ”)
打“ √ ”,错误的在( )内打“ ╳ ”)
1. ( ╳ ) 2. ( ╳) 3. ( ╳ ) 4. ( √ ) 5. ( ╳ ) 6. ( ╳ ) 7. ( ╳ ) 8. ( √ ) 9. ( √ ) 10. ( √ )
三、简答(每小题 5 分,共 30 分)
1. 简述吸光光度法测量条件。
答: 1 )测量波长的选择
2 )吸光度范围的选择
3 )参比溶液的选择
4 )标准曲线的制作
2. 以待分离物质 A 为例,导出其经 n 次液 - 液萃取分离法水溶液中残余量 (mmol) 的计算公式。
答: 设 V W ( ml )溶液内含有被萃取物为 m 0 (mmol), 用 V O ( ml )溶剂萃取一次,水相中残余被萃取物为 m 1 (mmol) ,此时分配比为:

用 V O ( ml )溶剂萃取 n 次,水相中残余被萃取物为 m n (mmol) , 则 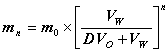
3. 酸碱滴定法和氧化还原滴定法的主要区别。
答:酸碱滴定法 :
• 以质子传递反应为基础的滴定分析法。
• 滴定剂为强酸或碱。
• 指示剂为有机弱酸或弱碱。
• 滴定过程中溶液的 pH 值发生变化。
氧化还原滴定法:
• 以电子传递反应为基础的滴定分析法。
• 滴定剂为强氧化剂或还原剂。
• 指示剂氧化还原指示剂和惰性指示剂。
• 滴定过程中溶液的氧化还原电对电位值发生变化。
4. 比较摩尔法和佛尔哈德法的异同点。
答: 两者均是以消耗银盐量来计算待测物含量。
摩尔法:
• 反应: Ag + + Cl - = AgCl ˉ ( 白色 ) ,中性或弱碱性介质。
• 滴定剂为 AgNO 3 。
• 指示剂为 K 2 CrO 4 , Ag + + CrO 4 2- = Ag 2 CrO 4 ˉ ( 砖红色 )
• SO 4 2- 、 AsO 4 3- 、 PO 4 3- 、 S 2- 有干扰。
• 可测 Cl - 、 Br - 、 Ag + ,应用范围窄。
佛尔哈德法:
• 反应: Ag + + Cl - = AgCl ˉ ( 白色 ) , Ag + + SCN - = AgSCN ˉ ( 白色 ) ,酸性介质。
• 滴定剂为 NH 4 SCN 。
• 指示剂为铁铵钒, Fe 3+ + SCN - = Fe(SCN) 2+ (红色)。
• 干扰少。
• 可测 Cl - 、 Br - , I - 、 SCN - 、 Ag + ,应用范围广。
5. 影响条件电势的因素。
答: 离子强度、酸效应、络合效应和沉淀效应
6. 重量分析法对沉淀形式的要求。
答: 1 )沉淀的溶解度必须很小。
2 )沉淀应易于过滤和洗涤。
3 )沉淀力求纯净,尽量避免其它杂质的玷污。
4 )沉淀易于转化为称量形式。
四、计算(每小题 10 分,共 30 分)
1. 有一纯 KIOx ,称取决 0.4988 克,进行适当处理后,使之还原成碘化物溶液,然后以 0.1125mol/L AgNO 3 溶液滴定,到终点时用去 20.72ml ,求 x ( K : 39.098, I : 126.90 , O : 15.999 )。
解: 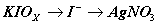 ,
, 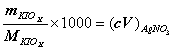
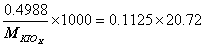 ,
, 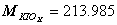 , X=3
, X=3
2. 将 1.000 克钢样中铬氧化成 Cr 2 O 7 2- ,加入 25.00ml 0.1000mol/L FeSO 4 标准溶液,然后用 0.0180mol/L KMnO 4 标准溶液 7.00ml 回滴过量的 FeSO 4 。计算钢样中铬的百分含量。( Cr:51.9961 )
解: Cr 2 O 7 2- + 6Fe 2+ + 14H + = 2Cr 3+ + 6Fe 3+ + 7H 2 O 2Cr ? Cr 2 O 7 2- ? 6Fe 2+
MnO 4 - + 5Fe 2+ + 8H + = Mn 2+ + 5Fe 3+ + 4H 2 O MnO 4 - ? 5Fe 2+
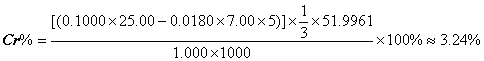
3. 在 1cm 比色皿和 525nm 时, 1.00 ′ 10 -4 mol/LKMnO 4 溶液的吸光度为 0.585 。现有 0.500 克锰合金试样,溶于酸后,用高碘酸盐将锰全部氧化成 MnO 4 - ,然后转移至今 500ml 容量瓶中。在 1cm 比色皿和 525nm 时,测得吸光度为 0.400 。求试样中锰的百分含量。( Mn:54.94 )
解: 根据