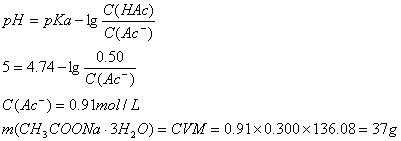《无机化学I》(A)参考答案
一、选择题:1 C. 2A. 3B. 4A. 5B. 6C. 7D. 8.D 9.C 10A.
二、填空题:1. 白,BaSO4, 无, CuS
2. 小,大,不变, 不变
3. 1.10, -424.534 kJmol-1,
4. NH3, Fe(H2O)63+;.
5.增大, 不变。
6. AgBr; Ag2C2O4,
7.0.00421, 1.76×10-5,。
8.
K![]() ([Zn(OH)4]2−)/K
([Zn(OH)4]2−)/K![]() ([Zn(NH3)4]2+.,
右
([Zn(NH3)4]2+.,
右
三、判断题 1√. 2√. 3√. 4×. 5×. 6√. 7×. 8×. 9×. 10√.
四、简答题
1. 使得冰的凝固点下降。
2. Hg2++ 2I-==HgI2; HgI2+ 2I-===HgI42-;。
3. Fe3+ +3OH- ==Fe(OH)3; Fe3+ + 6F- ==FeF63-;
4. φ![]() (Fe3+/Fe2+)>
φ
(Fe3+/Fe2+)>
φ![]() (Cu2+/Cu)..
2Fe3+ + Cu==2Fe2++Cu2+;
(Cu2+/Cu)..
2Fe3+ + Cu==2Fe2++Cu2+;
5.
φ![]() (O2/H2O)>φ
(O2/H2O)>φ![]() (Fe3+/Fe2+),
4Fe2++ O2+ 4H+==4Fe3+ +2H2O;
(Fe3+/Fe2+),
4Fe2++ O2+ 4H+==4Fe3+ +2H2O;
6.2[Ag(S2O3)2]3-+S2- =====Ag2S + 4S2O32-
7. d10离子无d-d跃迁, 无色。
五、计算题
1. k =
![]() =
=
![]() (d-1)
(0.069315);
(d-1)
(0.069315);
ln![]() =kt;
=kt;
![]() ;
Cx=0.5g;
;
Cx=0.5g;
2. Kb= Kw/Ka=![]() =1.56×10-10;
C/Kb>500,
=1.56×10-10;
C/Kb>500,
[OH-]=![]() =3.95×10-6;
(POH = 5.40)
=3.95×10-6;
(POH = 5.40)
PH=14-POH=14-[-lg(3.95×10-6)] =8.60;
3. ① 2H+ +2e===H2, △G1= -2Fφ1;
② H2O==H++OH- , △G2= -RTlnKw;
③2H2O+2e==H2+2OH-; △G3= -2Fφx;
①+2②==③, △G1+2△G2== △G3; 0+ 2×(-RTlnKw)== -2Fφx
φx ==![]() =0.0592×(-14)=-0.8288V
=0.0592×(-14)=-0.8288V
4. AgCl + 2NH3 = Ag(NH3)2+ +Cl- Ky = Kfy[Ag(NH3)2+]×Kspy(AgCl)= 2.72×10-3
初始浓度 6mol·L-1 0 0
平衡浓度(6-2x)mol·L-1 xmol·L-1 xmol·L-1
x2/(6-2x)2=2.72×10-3 x/(6-2x)=0.05215
x=0.2833
AgCl在6 mol·L-1氨水中的溶解度为0.2833mol·L-1。
5. Ea=111×103Jmol-1, T1=673K, k1=7.8 dm3·mol-1 ·s-1; T2=703K; k2=?
k=Aexp(-![]() );
);
![]() ;
;
![]()
k2= 18.2 dm3·mol-1 ·s-1;
6. BaSO4 ===========Ba2+ + SO42-;
初始 0.01 0
平衡(1.1×10-8) 0.01+1.1×10-8 ≈0.01 1.1×10-8
Ksp= [Ba2+][SO42-]=0.01×1.1×10-8=1.1×1010
BaSO4 ===========Ba2+ + SO42-;
(s1) s1 s1
(s2) s2 s2+0.1 ≈0.1
Ksp= [Ba2+][SO42-]=s12;
s1= ![]() mol·L-1;
mol·L-1;
Ksp= [Ba2+][SO42-]=s2×0.1; s2= Ksp/0.1= 1.1×1010/0.1=1.1×10-9 mol·L-1;
7. Fe(OH)2刚开始沉淀时,Fe2+ + 2OH- = Fe(OH)2 500 ´ ([OH-])2 = 4.87 ´ 10-17
[OH-] = 9.87 ´ 10-9 mol·dm-3 pH = 5.99
Fe(OH)3沉淀完全时,Fe3+ + 3OH- = Fe(OH)3
1.0 ´ 10-5 ´ ([OH-])3 = 2.64 ´ 10-39
[OH-] = 6.4 ´ 10-12 mol·dm-3 pH = 2.81 所以应控制2.81 < pH < 5.99。
《无机化学I》(B)参考答案
一、选择题:1 B. 2A. 3D. 4C. 5B. 6B. 7D. 8.C 9.A 10 D .
二、填空题:1. 饱和,等于, 减小,同离子效应;
2.蒸汽压下降,沸点升高,凝固点降低, 产生渗透压
3.碱, 酸, HCO3-; [Fe(OH)(H2O)5]2+
4. 2s; 108s5;
5 1.454V.
6.
φ![]() (Cu2+/Cu)、
(Cu2+/Cu)、
7. 小, [Zn(NH3)4]2++2en=== [Zn(en)2]2++ 4NH3,
8. 反应历程, 活化能
三、判断题 1×,2. √, 3× 4×. 5. √, 6√,.7√, 8×, 9√ ,10×,
四、简答题
1. 答 细胞内渗透压比河水大,与海水相近。前者产生细胞肿胀。
2. 答:AgCl+2NH3===Ag(NH3)2+ + Cl-;。
3.答:水的凝固点降低了。
4.答:MnO4-+8H++5e===Mn2++4H2O;
φ
=
φ![]() +
+ ![]()
5. 答:电动势增大,因为Zn2+/Zn电对做负极,加氨水后,Zn2+形成配离子,Zn2+浓度降低,电极电势下降。
6. 2FeCl4- + Zn ===Zn2++ 2Fe2+ + 8Cl-; 2Fe3+ + Zn ===Zn2++ 2Fe2+
7. Cu+ 为d10结构, 无d-d。
五、计算题
1. Kb= Kw/Ka=![]() =5.56×10-11;
C/Kb>500,
=5.56×10-11;
C/Kb>500,
[OH-]=![]() =2.36×10-6;
(POH = 5.63)
=2.36×10-6;
(POH = 5.63)
PH=14-POH=14-[-lg(2.36×10-6)] =8.37;
2. △rGmy = 2△fGmy(Br-)-△fGmy[Br2(l)]-2△fGmy(e-) = 2 (-104)-0-0
= -208 kJ.mol-1 =-208×103 J.mol-1
φy(Br2/Br-) =(-208×103)/(-2×96485)=1.078 V
3. 2Cu+===Cu2+ + Cu,
lgK===nEy/0.0592==2×(0.522-0.158)/0.0592==12.30, K= 2.0×1012,
4. Al(OH)3 + 6F-===AlF63-+ 3OH-,
![]() =Ksp[Al(OH)3]·Kf(AlF63-)=
=Ksp[Al(OH)3]·Kf(AlF63-)=
===1.1×10-33×6.9×1019==4.29×10-14;
5. 由 pH = pKa- lg(c(HAc)/c(Ac-)) 得:pH = 4.75- lg( 0.1/0.3)
=4.75 +0.4771= 5.23
6. T1=781K, k1=0.079 dm3·mol-1·s-1; T2=813K; k2=0.24 dm3·mol-1·s-1
k=Aexp(-![]() );
);
![]() ;
;
![]()
Ea= 183312J·mol-1 =183.31 kJ·mol-1 ;
7.