第八章:化学热力学
1.掌握内能、焓、熵、自由能等状态函数的物理意义。
2.了解热力学三大定律的基本内容和表达方式。
3.掌握几种热效应的计算方法,及盖斯定律的意义和应用。
4.利用熵或自由能的变化来判断化学反应的方向。
重点复习
化学热力学是研究体系中发生的能量转换和体系与环境间发生的任何能量传递的一门学问。利用热力学第一定律解决化学变化的热效应问题,利用热力学第二定律解决化学反应自发进行的方向问题,利用热力学第三定律解决绝对熵数值。
(一)热力学第一定律
自然界的一切物质都有能量,能量可以从一种形式转化为另一种形式。在转化过程中能量的总值不变,热力学第一定律也就是能量守恒定律,其数学表达式如下:
⊿U = Q – W (1)
这里⊿U体系终态和始态间的内能差。(1)式说明:在变化过程中,体系所吸收的热减去体系对环境所作的功,等于体系内能的变化。内能为体系所储存的总能量,内能的绝对值无法知道,只有当体系与环境有功与热的传递时。才可确定体系内能的变化值。
必须指出,应用(1)式进行计算时,要特别注意Q和W正负号选用的习惯。本书规定:凡体系吸收热量,Q是正值,体系放出热量,Q是负值;体系对环境作功,W是正值,环境对体系作功,W为负值。
1.热效应,焓
当体系发生了变化以后,使反应产物的温度回到反应前原始物质的温度,体系放出或吸收的热,叫做这个过程的热效应或反应热。不同的过程有不同的热效应,如Qv表示但容热效应,Qp表示恒压热效应,大多数化学反应都在敞开容器即恒压下进行,因此我们一般指的热效应,如不标明,即
为恒压热效应。
根据热力学第一定律,可以推出以状态函数焓的变化表示恒压
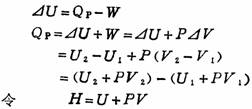
U、P、V都是状态函数,所以H也是状态函数,我们把这个新的状态函数叫做焓。
![]()
式(2)表明,除做膨胀功外不做其他功的条件下,体系在恒压过程中所吸收的热量,全部用来增加体系的焓,因此可以利用焓变计算化学反应热效应;
焓的性质:
(1)由于U、P、V为状态函数,焓也是状态函数。内能的绝对值无法知道,焓的绝对值也无法知道。反应的焓变,即恒压过程的反应热。
(2) ⊿H与反应物的数量有关。
(3)正反应的⊿H=-逆反应的⊿H
若在恒容条件下进行化学反应,⊿V=0
则: ⊿U=QV - P⊿V=QV (3)
式(3)表明在恒容过程中,体系所吸收的热全部用来增加体系的内能。
恒容热效应与恒压热效应关系如下式:
QP=QV + P⊿V
或⊿H=⊿U+P⊿V
=⊿U+⊿nRT (4)
这里⊿n指反应前后气体摩尔数的改变。
2.盖斯(Hess)定律
实验证明:不管化学反应是一步完成或分步完成,这个过程的热效应总是相同的,这就是盖斯定律。
盖斯定律适用于恒压热效应、恒容热效应及一切状态函数,因为⊿U=QV;⊿H=QP,而U、H都是状态函数,状态函数只与始态、络态有关而与过程无关。盖斯定律有广泛的应用,可由已知反应热效应求未知反应热效应,及由波恩-哈伯循环求晶格能及键能等,都应用盖斯定律。
3.掌握热效应方面的有关计算
(1)由标准生成热求反应热
由于焓的绝对值无法知道,我们指定在1大气压和进行反应温度时,最稳定状态单质焓等于零作为相对标准。
标准生成热:在1大气压和指定温度下(通常为25℃),由元素的稳定单质生成1摩尔化合物的热效应称为标准生成热,用⊿Hof表示。
由标准生成热求反应热由下列说明:
|
CaCO3(S) |
|
CaO(s)+CO2 |
![]() ⊿H10
⊿H10
![]() ⊿H20
⊿H20
|
Ca(s)+C(石墨)+2/3O2(g) |
根据盖斯定律
⊿H0=⊿H01+⊿H02=⊿H0fCaCO3(s)+⊿H0fCO2(g)+⊿H0fCaO(s)
=⊿H0fCO2(g)+⊿H0fCaO(s)-⊿H0fCaCO3(s)
![]()
![]()
(2)由燃烧热求反应热
燃烧热:1摩尔物质与氧气完全燃烧时所产生的热效应。
![]()
注意:由燃烧热求反应热是反应物燃烧热总和减去产物燃烧热总和,与生成热求反应热相反。不必死记硬背,可由下式理解:
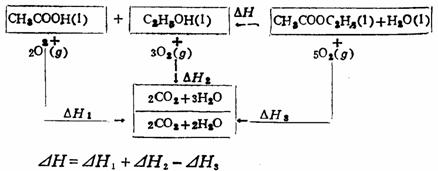
由燃烧热求反应热,主要用于有机化合物,因为有机化合物生成热难求,燃烧热易求,由于燃烧热数值大,所以误差大。
(3)从键能估计反应热
一切化学反应,实际上都是原子或原子团的重新排列和组合。化学反应过程是破反应物分子、立产物分子的过程。化学反应的反应热,就是来源于旧化学键破坏和新化学键形成过程中所发生的能量变化。由于破坏旧键需要吸收热量,而形成新键一般放出热量,所以由键能估计反应热的公式为:
![]()
由键能估计反应热是个近似方法,目的是从微观角度了解反应热的来源,而不是想从键能获得反应热数据。只有当合成一个新化台物而它的热力学函数值尚未测得时,才用这种方法估计反应热。
(二)热力学第二定律
热力学第二定律解决化学反应自发进行的方向问题。有两个因素影响着过程的自发性,一个是能量变化,体系将趋向最低能量;一个是混乱度变化,体系将趋向最高的混乱度。为了说明混乱度,热力学引进状态函数熵的概念。
1.熵
熵是在热力学上用作度量体系混乱度大小的一个状态函数,用符号S表示。
S=f(Ω) Ω表示体系的混乱度
熵是混乱度的函数,体系越混乱,熵值越大。
(1)气体熵>液体熵>固体熵
大分子熵>小分子熵
(2)热力学第二定律:在孤立体系中,自发过程总是朝着熵增加的方向进行。
孤立体系是指在体系和环境之间,既没有物质交换也没有能量交换。真正的孤立体系是不存在的,因为能量交换不能完全排除,但是我们若将与体系有物质或能量交换的那一部分环境也包括进去而组成一个新体系,这个新体系就可算作孤立体系。因此:
⊿S孤立 = ⊿S体系 + ⊿S环境﹥0 自发过程
⊿S孤立 = ⊿S体系 + ⊿S环境﹤0 不可能产生自发反应
(3) ⊿S孤立=Q可逆/ T 在相同温度下,体系的熵值增加,同给体系加入的热量有关,加入热量越多,熵值增加越大。加入热量相同、温度不同时,低温时熵值增加大,高温时熵值增加小。
2.自由能及其应用
用⊿S孤立>0来判断反应的自发性不甚方便,因为它既要涉及到体系,又要涉及到环境。因此我们常作如下的变换,对于等温等压过程来说,传入环境的热量,等于传入体系热量的负值。

对于自发变化,T⊿S孤立>0,则T⊿S体系-⊿H体系>0 即 ⊿H -T⊿S<0。
为了方便起见,引入另一个热力学。函数——吉氏函数,简称为自由能,用符号G表示,其定义为: G=H-TS
则 ⊿G=⊿H—T⊿S
一般反应都在等温等压过程中进行,用自由能变化JG作为判断过程的自发与否,
⊿G<0 自发进行。
⊿G>o 不可能自发进行(逆过程为自发)。
⊿G=0 过程处于平衡状态。
3.对公式⊿G=⊿H—T⊿S的讨论
(1) 公式说明体系有取得低势能、最大混乱度的倾向
⊿H>0放热反应,体系势能降低,⊿S>0 熵值增加,混乱度增大,两因素都对自发过程有利,不管什么温度下,⊿G总是负值,过程总是自发。
(2)大多数化学反应,熵变很小,焓变较大,在温度不太高时,⊿H正负号决定反应方向。所以大多数放热反应都是自发进行。
(3)温度对自由能的影响:有些吸热反应熵变较大,有气体产生,当温度作大幅度改变时,常可导致改变⊿G符号。例
![]()
⊿Ho=178KJ.mol-1,⊿So=l 60JK-1mol-1
在常温下此反应⊿G>o,不能自动进行,但当高温时T⊿S>⊿H T>⊿H/⊿S=1112.5(K) 刚⊿G<0,反应能自动进行。
温度对⊿G的影响及反应自发进行的条件,以下表说明。
|
⊿H |
⊿S |
⊿G=⊿H-T⊿S |
反应情况 |
|
— |
+ |
永远是负值 |
在任何温度下过程均自发进行 |
|
+ |
— |
永远是正值 |
在任何温度下过程非均自发进行 |
|
+ |
+ |
低温为正 高温为负 |
当⊿H∠T⊿S反应能自发进行 例如CaCO3(s)⊿CaO(s)+CO2(g) |
|
— |
— |
低温为负 高温为正 |
低温时自发T⊿S∠⊿H 高温时非自发 如:水结冰 |
4.标准生成自由能
规定在反应进行温度(一般是25℃)和1大气压下,由稳定单质生成1摩尔化合物时标准自由能的变化,称为标准生成自由能,以⊿Gof表示之。与焓一样,规定稳定单质的标准生成自能为零。
由标准生成自由能求反应自由能变化的公式如下:
![]()
(三)热力学第三定律
熵是表示体系混乱度的热力学函数。对纯净物质的完整晶体,在绝对零度时,分子间排列整齐,且分子任何热运动也停止了,这时体系完全有序化了,因此热力学第三定律指出,在绝对零度(OK)时,任何纯物质完整晶体熵为零。所以热力学第三定律解决绝对熵问题
以标准绝对熵求反应熵变公式如下:
![]()
注意,单质熵的数值不为零。