第七章:元素及其化合物
一、S 区元素
(一)通性
1.它们的价电子构型为ns1-2, 内层为稀有气体稳定电子层结构。价电子很易失去呈+1、+2氧化态。都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2.有较大的原子半径。因为每一周期是从碱金属开始建立新的电子层。原子半径变化的规律:同周期从IA到IIA减小,同族中从上到下增大。
3.电离势和电负性均较小,其变化规律为同周期从IA到IIA增大,同族中从上到下顺序减小。
(二)物理性质
单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。它们在密度、 熔点、沸点和硬度方面往往差别较大。
(三)化学性质
1.它们具有很高的化学活泼性,能直接或间接地与电负性较高的非金属元素形成相应的化台物。如可与卤素、硫、氧、磷、氮和氢等元素相化合。一般均形成离子化台物(除Li、Be及Mg的卤化物外)。
2.单质与水反应放出氢气。其中Be和Mg由于表面形成致密的氧化膜因而对水稳定。
3.标准电极电势均很负,是很强的还原剂。它们的还原性在于态及有机反应中有广泛的应用。如高温下Na、Mg、Ca能把其它一些金属从氧化物或氯化物中还原出来.
4.单质制备
由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。单质的制备多数采用电解它们的熔盐。
(四)氧化物和氢氧化物
1.碱金属的氧化物比碱土金属的氧化物种类多。它除有正常氧化物外,还有过氧化物、超氧化物及臭氧化物。
如碱金属在空气中燃烧时,只有Li的主要产物是Li2O(正常氧化物),而Na、K、Rb、Cs的主要产物分别是Na2O2(过氧化物)、KO2(超氧化物)、 RbO2(超氧化物)和Cs2O2(过氧化物)。
2.氢氧化物除Be(OH)2呈两性外,其余均为中强碱或强碱。
(五)盐 类
1.碱金属的盐类
有MX(卤化物)、MNO3、M2SO4、M2CO3、M3PO4等。它们的共性如下:
①都是离子晶体(Li盐除外);
②都易溶解。除Li盐和极少数大阴离子组成的盐以外,例如LiF、Li2CO3、Li3PO4、 Na[Sb(OH)6]、NaZn(UO2)3(CH3COO)9·6H2O等均难溶。
③热稳定性均很高,但Li 2CO3和硝酸盐除外,它们加热会分解:
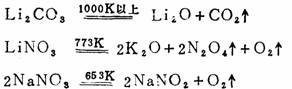
④易形成复盐。
光卤石类通式: M+Cl·MgCl2·6H2O (M+=K+,Rb+,Cs+)
矾类通式: M2+SO4·MgSO4·6H2O (M+=K+,Rb+,Cs+)
2.碱土金属盐类
![]() 其溶解度与碱金属盐有些差别。它们的碳酸盐、磷酸盐和草酸盐均难溶。BaSO4、BaCrO4的溶解度亦很小。
其溶解度与碱金属盐有些差别。它们的碳酸盐、磷酸盐和草酸盐均难溶。BaSO4、BaCrO4的溶解度亦很小。
它们的碳酸盐在常温下均较稳定(BeCO3例外),但加热可分解:
热稳定性由Mg到Ba顺序增强。
二、P区元素
(一)卤族元素
1.通性
(1)外层电子结构ns2np5,很容易得到一个电子呈八电子稳定结构,所以卤族元素显强氧化性。
(2)氧化能力 F2>Cl2>Br2>I2
F2、Cl2可与所有金属作用,Br2、I2可与除贵金属外所有金属作用。
F2是最强的氧化剂,能与稀有气体反应生成XeF2、XeF4、XeOF4;与水猛烈反应放出O2。
(3)化合价:由卤素电子层结构ns2np5决定,除了易获得一个电子显-1价外,氯、溴、碘的原子最外层电子结构中存在空的nd轨道,当这些元素与电负性更大的元素化合时,它们的nd轨道可以参加成键,原来成对的p电子拆开进入nd轨道中,因此这些元素可以表现更高的氧化态+1、+3、+5、+7。这一类化台物主要是卤素含氧化合物和卤素互化物,主要形成共价键。氟原子外层电子结构是2s22p5,价电子是在L层上,没有空d轨道,而且F的电负性最大,仅显+1价。
2.卤化氢
制备:在实验室里由浓H2SO4与NaCl作用制得少量HCl。而HBr、HI不能由浓H2SO4与NaBr、NaI作用制得,这是因为浓H2SO4对所生成的HBr及HI有氧化作用,使其中一部分被氧化成单质Br2及I2析出。
(浓)H2SO4+2HBr=Br2+SO2+2H2O
(浓)H2SO4+8HI=4I2+ H2S+4H2O
可由H3PO4代替H2SO4制备HBr、HI,避免以上氧化作用。
性质:HF最稳定,高温下不分解,而HI在300℃即大量分解为I2与H2。 HF有强腐蚀性,并能腐蚀玻璃 SiO2 + 4HF=SiF4 + 2H2O ⊿Go=-75.2干焦/摩
3.卤化物及多卤化物
(1)氯化物AgCl、Hg2Cl2、PbCl2,CuCl难溶于水,其它易溶于水。
(2)由于氟的氧化性强,元素在氮化物中可呈高氧化态。例如一般卤素银盐为AgX,但有AgF2存在。由于碘离子还原性强,碘化物中元素呈低价氧化态,如FeI2较稳定。
(3)卤化物可和相同或不相同的卤素分子形成多卤化物,最常见的多卤化物是KI3,是由I2溶于KI中形成。多卤化物所含的卤素可以是一种,也可以是两种或三种,如RbBrCl2、CsBrICl。只有半径大,电荷少的金属离子适于形成多卤化物。
4.卤素的含氧酸
卤素的含氧酸以氯的含氧酸最为重要。
因素含氧酸和含氧酸盐的许多重要性质,如酸性、氧化性、热稳定性、阴离子碱的强度等都随分子中氧原子数的改变而呈规律性的变化。以氯的含氧酸和含氧酸盐为代表将这些规律总结在表中。
卤素含氧酸及其盐的稳定性与它们的氧化能力有相应的关系。稳定性较差,氧化能力较强。反之,稳定性高的氧化能力就弱。
|
氧化态 |
酸 |
热稳定性和酸的强度 |
氧化性 |
盐 |
热稳定性 |
氧化性及阴离子碱的强度 |
|
+1 |
HOCl |
向下增大
|
向上增大
|
NaClO |
向下增大
|
向上增大
|
|
+3 |
HClO2 |
NaClO2 |
||||
|
+5 |
HClO3 |
NaClO3 |
||||
|
+7 |
HClO4 |
NaClO4 |
(二)氧族元素
1.通性
(1)价电子层结构ns2np4,氧化态-2、+2、+4、+6,氧仅显-2价(除H2O2及OF2外)。
(2)氧族元素原子最外层6个电子,因而它们是非金属(钋除外),但不及卤素活泼。
(3)随着原子序数增大,非金属性减弱,氧硫是非金属、硒、碲是半金属,钋是典型金属。氧的电负性最高,仅次于氟,所以性质非常活泼,与卤族元素较为相似。
2.过氧化氢
制备:电解60%H2SO4溶液,减压蒸馏得H2S2O8,水解可得H2O2。
H2S2O8+2H2O=2H2SO4+H2O2↑
性质:(1)不稳定性:H2O2=H2O + 1/2O2
光照及少量金属离子存在都能促进分解。
(2)氧化还原性:由于H2O2氧化数处于中间,所以既显氧化性又显还原性,以氧化性为主。
(3)弱酸性:H2O2+Ba(OH)2=BaO2+2H2O
(1)硫化氢
制备: FeS + 2HCl=FeCl2 + H2S
H2S是一种有毒气体,需在通风橱中制备。实验室中以硫代乙酰胺水解产生H2S。
CH3CSNH2 + 2H2O=CH3COONH4 + H2S
性质:①还原性。硫化氢水溶液不能长久保存,可被空气中的氧气氧化析出S。
②沉淀剂。由于大多数金属硫化物不溶于水,在定性分析中,以H2S作为分离溶液中阳离子的沉淀剂。
检验:以Pb(Ac)2试纸检验,H2S使试纸变黑:
H2S+Pd(Ac)2=PdS+2HAC
(2)硫化物
为什么大多数金属硫化物难溶于水,从结构观点来看,由于S2-变形性大,如果阳离子的外电子构型是18、18+2或8~18电子构型,由于它们的极化能力大,变形性也大,与硫离子间有强烈的相互极化作用,由离子键向共价键过渡,因而生成难溶的有色硫化物。
4.硫酸
浓H2SO4与稀H2SO4氧化性不同。在稀H2SO4,显氧化性的主要是H+。
浓H2SO4是强氧化剂,其中显氧化作用的是S6+,它可以氧化其他物质,而本身被还原成低氧化数的SO2、S、H2S等等
5,亚硫酸及其盐
性质:(1)不稳定性; (2)由于S4+氧化数处于中间,既显还原性,又显氧化性,以还原性为主。配制Na2SO3溶液必须随配随用,放置过久则失效。(3)Na2SO3与S作用。
(三)氮族元素
1. 通性
(1)价电子层结构为ns2np3,主要氧化态为-3、+3、+5。
(2)氮族元素得电子趋势较小,显负价较为困难。因此氮族元素的氢化物除NH3外都不稳定,而氧化物均较稳定。
(3)由于从As到Bi,随着原子量的增加,ns2惰性电子对的稳定性增加。
2.氨和铵盐
(1)NH3具有还原性:
![]()
(2)配合性:由于,NH3上有孤对电子 Ag+十2NH3=[Ag(NH3)2]+
(3)NH4+与K+电荷相同、半径相似,一般铵盐性质也类似于钾盐。它们的盐类同晶,并有相似的溶解度。
3. 硝酸及硝酸盐
(1)HNO3是强氧化剂,许多非金属都易被其氧化为相应的酸,而HNO3的还原产物一般为NO。
HNO3几乎溶解所有的金属(除Au、P外),HNO3的还原产物决定于HNO3浓度及金属的活泼性。浓HNO3一般被还原为NO2,稀HNO3还原产物为NO,活泼金属如Zn、Mg与稀HNO3还原产物为H2O,极稀HNO3的还原产物为NH4+。
(2)硝酸盐较硝酸稳定,氧化性差,只有在酸性介质及焰部态才显氧化性。
4.磷的含氧酸
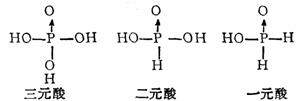
(1)磷在充足的空气中燃烧生成P4O10,这是由P4四面体结构所决定。磷酐与水作用先形成偏磷酸,然后是焦磷酸,最后得到正磷酸。都是以磷氧四面体为结构基础。
(2)H3PO4、H3PO3、H3PO2都以磷氧四面体结构为特征。
(四)碳族元赛
1.通性
(1)价电子结构为ns2np2,氧化态+2、+4。
(2)以Ge到Pb,ns2惰性电子对稳定性增强。
2.碳酸及碳酸盐
(1)CO2溶于水存在平衡,大部分以CO2.H2O的形式存在,只有少部分形成H2CO3,与SO2溶于水的情况相似。
(2)碳酸盐水解
由于碳酸是很弱的酸,所以碳酸铂在溶液中水解呈较强的碱性,称为纯碱。
(3)Na2CO3溶液中加入金属离子,生成何种沉淀,根据碳酸盐及氢氧化物溶解度大小来决定。
①金属氢氧化物溶解度小于碳酸盐溶解度,则生成氢氧化物沉淀,如Fe(III)、AI(III)、Cr(III)。
②金属氢氧化物溶解度相近于碳酸盐的溶解度,则得到碱式碳酸盐沉淀,如Bi(III)、Hg(II)、Cu(II)、Mg(II)。
③金属碳酸盐的溶解度小于氢氧化物溶解度,则得到碳酸正盐沉淀,如Ba(II)、Ca(II)、Cd(II)、Mn(II)、Pb(II)。
3.硅酸及硅酸盐
(1)硅酸:在实验室中,用盐酸与可溶性硅酸盐作用可得硅酸,硅酸是很弱的酸,在水中溶解度小。在水中随条件不同,逐步聚合成硅酸凝胶。
(2)由于硅酸很弱,N a2SiO3在溶液中强烈水解呈碱性
(3)鉴定SiO32-:在SiO32-溶液中加入NH4Cl,发生完全水解,且有H2SiO3沉淀生成并放出NH3。
(五)硼族元素
1.通性
(1)价电子层结构为ns2np1,氧化态+1,+3。硼、铝、镓、铟四个元素都以+3价为特征,铊由于“ns2惰性电子对效应”则主要表现为+1价。
(2)在硼族元素+3价共价化合物中, 中心原于外层只有6个(3对)电子,仍未满足稳定8电子外层结构,还有一个空轨道,因而这些化合物均有很强的接受电子的趋势,容易与具有孤对电子的分子或离子形成配合物,这个特征被称为“缺电子”特征。以硼的化台物最为明显。
2.硼化合物缺电子特征
(1)BF3易与HF、NH3等加合
(2)H3BO3为一元酸
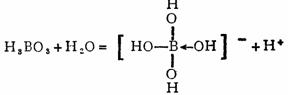
这种酸的离解方式表现了硼化合物的缺电子特征。
(六)P区元素小结
以上我们复习了P区各族元素的性质和电子层结构的关系及其重要化合物的性质。 下面以六大性质:酸碱性、热稳定性、熔沸点、溶解度、水解性及氧化还原来总结P区元素性质递变规律。
1.酸碱性强弱
(1)R-O-H规则:以离子势Φ判别 Φ=离子电荷/离子半径
Φ大,及对O引力大,O电子云密度小,O-H键易断裂,酸性增强。
①同一周期中,不同元素的合氧酸酸性自左至右增强。由于从左至右离子电荷增高,半径变小,Φ增大,所以酸性增强。
②同一主族中,不同元素的含氧酸自上而下酸性逐渐减弱。离子电荷相同,自上而下随着周期数增大,半径增大,Φ变小,所以酸性减弱。
③同一元素形成几种不同氧化数的含氧酸,其酸性随着氧化数的升高而增强。
(2)鲍林规则:配价键多,酸性强。
含氧酸可以写成如下式子:ROm(OH)n,m加大,酸性强。
两种理论发生矛盾时,以配价键多少为主 。
2.热稳定性
碳酸盐加热分解为金属氧化物,放出CO2,金属离子的极化能力强,即对氨的反极化能力强,碳酸盐的热稳定性差。由于Be2+是2电子结构,极化朗力最强,所以BeCO3的分解温度最低。Mg2+——Ba2+离子电荷相同,但离子半径增大,极化能力减小,所以碳酸盐热稳定性增加。
由于H+的反极化能力强,热稳定性顺序为 H2CO3<NaHCO3<Na2CO3
硝酸盐的热分解产物因金属离子不同而不同。

注意:硝酸分解与碳酸盐不同,由于N-O键不牢,加热易断裂,所以硝酸盐分解放出O2,并在高温时有氧化性。
同一成酸元素、不同氧化态的含氧酸及其盐中心离子氧化数高,对O2-的极化能力强,稳定性高, 例如热稳定性变化顺序为
HClO4>HClO3>HClO2>HClO
H2SO4>H2SO3
HNO3>HNO2
3.溶解度 离子化合物的溶解度决定于晶格能及离子的水合能。
① 晶格能大,溶解度小。
Ca(H2PO4)2 CaHPO4 Ca2(PO4)3
易溶 难溶 难溶
阴离子电荷高,晶格能大,溶解度小。
②水合能小,溶解度小。 一般碱金属的盐类易溶于水,仅少数碱金属盐是难溶的。这些难溶盐一般都是由大的阴离子组成,而且碱金属离子越大,难溶盐的数目越多,这是由于当阴阳离子大小相差悬殊时,离子水合作用在溶解过程中占优势。
水合能小,则溶解度小。例如碱金属高氯酸盐溶解度:
N aClO4>KClO4>RbClO4
同理,由于Mg2+到Ba2+半径增大,离子势减小,水合
能减小,则MsSO4到BaSO4的镕解度减小。
②共价成分大,溶解度小。
ZnS CdS HgS 溶解度减小
溶于稀HCl 溶于浓HCl 溶于王水
这是由于Zn2+、Cd2+、Hg2+18电子构型,不仅极化能力强,变形性也强,随着Zn2+、Cd2+、Hg2+半径增大,变形性增大,附加极化效应增大,共价成分增大,溶解度减小。
④聚合程度大,溶解度小。
H3BO3由于氢键联成大片,为固体酸,在冷水中溶解度小,可溶于热水。
NaHCO3的溶解度小于Na2CO3,由于NaHCO3通过氢键而聚合。
4.溶沸点高低
(1)离子化合物晶格能大,熔沸点高。 由于从Li+到Rb+离子半径增大,离子电荷不变,与F-之间引力减弱,晶格能减小,熔沸点降低。
(2)共价成分大,熔沸点低。 由于从Na+到Si4+离子正电荷升高,半径减小,极化能力增大,由离子键向共价键过渡,熔沸点降低。
(3)非极性分子,分子量增大,色散力增大,熔沸点升高。
(4)HF由于形成氢键而缔合,所以熔沸点高。HCl—HBr—HI随着分子量增大,色散力增大,故熔沸点升高。分子间的三种力,以色散力为主。
(5)SiO2为原子晶体,原子间以共价键相结合,结合力大,所以熔沸点高。而CO2是分子晶体,分子间以范德华力结合,结合力小,所以CO2在室温下是气体。
5.盐类的水解
盐类的水解分离子化合物及共价化合物两种情况讨论。
(1)离子化合物的水解
离子化合物水解的实质是弱酸或弱碱盐的离子与水中电离产生的H+或OH-结合,使水解平衡移动。
①阳离子 其共轭碱越弱,水解度越大。 例如:水解度 AsCl3>SbCl3>BiCl3
由于碱性 As(OH)3<Sb(OH)3<Bi(OH)3
②阴离子 其共轭酸越弱,水解度越大。
强硬的阴离子如ClO4-、NO3-等不水解,它们对水pH值无影响,但是弱碱的阴离子如CO32-及SiO42-等明显水解,使溶液pH值增大。
(2)非金属卤化物的水解
①非金属卤化物的水解首先是由水分子以一对孤电子对配位于与卤素结合的元素的原子上,然后排出卤离子和氢离子。
②非金属卤化物能否水解,决定于中心原子的配位数是否已满,若中心原子的配位数已满,水就不能配位上去,不能水解,例如CCl4不水解而SiCl4水解。
③水解类型
BCl3 + 3H2O=H3BO3 + 3HCl
SiCl4 + 4H2O=H2SiO4 + 4HCl
PCl5 + 4H2O=H3PO4 + 5HCl
NCl3 + 3H2O=NH3 + 3HOCl
前三种类型是H2O中OH-离子与中心原子相结合,生成含氧酸。而第四种类型是H+与中心离子相结合,OH-与C1结合生成次氧酸。由于NCl3中N原子周围已有4对电子对,但配位数未满,有一对孤对电子,水分子中的氢原于有空的轨道,所以与N的孤电子对结合,发生水解作用。
(3)防止水解及水解的应用。
①配制溶液时,常因水解生成沉淀,为了防止水解,需加相应酸。如 SnCl2+H2O=Sn(OH)C14+HCl
在上式反应中加HCl可使水解平衡向左移动,防止沉淀产生。
②制备无水盐,需考虑水解。如 ZnCl2·H2O = Zn(OH)C1+HCl
在上述反应中,蒸发脱水时由于温度升高,水解度增大,不能得到无水盐,只能得到水解产物。只有在氯化氢气氛中蒸发,才能得到无水盐。
6.氧化还原性
(1)含氧酸及其盐的氧化还原性
①含氧酸的氧化还原性与其氧化数有关,氧化数最高的含氧酸仅显氧化性,如HNO3、浓H2SO4。 氧化数处于中间状态,既显氧化性又显还原性,如HNO2、H2SO3。成酸元素氧化态处于最低时仅显还原性,如NH3、H2S。
②在同一周期中,各元素最高氧化态含氧酸的氧化性从左到右增强,例如H2SiO4和H3PO4几乎无氧化性,H2SO4只有在高温和浓度大时表现强氧化性,而HClO4是强氧化剂。
③氧化还原性与稳定性有关,同一元素不同价态的含氧酸越稳定,其氧化性就越弱,反之稳定性越差、氧化性越强。
④溶液的pH值对含氧酸及其盐的氧化还原性影响很大。同一物质在不同pH值条件下,其氧化还原强度不同,含氧酸盐在酸性介质中的氧化性比在中性或碱性介质中强,含氧酸盐作还原剂时,在碱性介质中还原性比酸性介质中强。
(2)非金属单质的氧化还原性
① B、Si在碱性溶液中与H2O作用放出H2气。
②C、N、O与H2O不反应。
③F2与H2O作用放出O2气。
④P、S、C12、Br2、I2与碱作用发生歧化反应。
(七)P区元素氢化物的性质递变规律
1.稳定性
对于同一族元素从上到下、对于同一周期元素从右到左电负性减小,与氢结合能力减弱,稳定性减弱。以氮族氢化物为例,NH3很稳定,PH3加热则分解为其组成元素。AsH3和SbH3在室温时逐渐自动分解,BiH3很容易分解。
2.还原性
除了HF外,其它分子型氢化物都有还原性。氢化物HnA的还原性来自An-,而且An-失电子能力和其半径及电负性大小有关。在周期表中,从上到下、从右到左,An-的半径增大,电负性减小,An-失电子能力依上述方向递增,所以氢化物还原性也按此方向递增。以第三周期氢化物为例,SiH4与PH3、空气或氧接触即自动燃烧,H2S需加热才能在氧中燃HCl需加热加催化剂才能与氧作用。
3.酸碱性
按质子理论,物质为酸或碱,是与它能否给出和接受质子有关,而酸碱强度又与给出质子和接受质子的难易程度有关。碳族元素的氢化物既不给出质子又不接受质子,无所谓酸碱性。氮族元素的氢化物接受质子的倾向大于给出质子的倾向,所以它们是碱。而氧族元素及卤素的氢化物大部分是酸,个别的如H2O既是酸又是碱。
三、ds区元素
重点复习
铜、银、金位于周期表I B族,锌、镉、汞位于周期表IIB族,这两族元素属于ds区,结构特征铜族为(n-1)d10ns1,锌族为(n-1)d10ns2。从最外层电子说,铜族和IA族的碱金属元素都只有1个电子,失去S电子后都呈现+1氧化态;锌族和II A族的碱土金属元素都有两个S电子,失去S电子后都能呈+2氧化态。因此在氧化态和某些化合物的性质方面I B与I A、II B与II A族元素有一些相似之处,但由于I B与IIB族元素的次外层比I A与II A族元素多出10个d电子,它们又有一些显著的差异。
(一) I B族元素和I A族元素性质的对比
1.与同周期的碱金属相比,铜族元素的原子半径较小,第一电离势较大,表现在物理性质上; I A族单质金属的熔点、沸点、硬度均低;而I B族金属具有较高的熔点和沸点,有良好的延展性、导热性和导电性。
2.化学活泼性:铜族元素的标准电极电势比碱金属为正。I A族是极活泼的轻金属,在空气中极易被氧化,能与水剧烈反应,同族内的活泼性自上而下增大;IB族都是不活泼的重金属,在空气中比较稳定,与水几乎不起反应,同族内的活泼性自上而下减小。
3.铜族元素有+1、+2、+3等三种氧化态,而碱金属只有+1一种。碱金属离子一般是无色的,铜族水合离子大多数显颜色。
4.IIA族所形成的化合物多数是离子型化合物,I B族的化合物有相当程度的共价性。IA族的氢氧化物都是极强的碱,并且非常稳定;IB族的氢氧化物碱性较弱,且不稳定,易脱水形成氧化物。
5.IA族的离子一般很难成为配合物的形成体,IB族的离子有很强的配合能力。
(二)II B族元素和II A族元素性质的对比
锌族元素由于次外层有18个电子,对原子核的屏蔽较小,有效核电荷较大,对外层S电子的引力较大,其原子半径、M2+离子半径都比同周期的碱土金属为小,而其第一、第二电离势之和以及电负性都比碱金属为大。由于是18电子层结构,所以本族元素的离子具有很强的极化力和明显的变形性。因此锌族元素在性质上与碱土金属有许多不同。对比如下:
1.主要物理性质 IIB族金属的熔、沸点都比II A族低,汞在常温下是液体。II A族和II B族金属的导电性、导热性、延展性都较差(只有镉有延展性)。
2.化学活泼性 锌族元素活泼性较碱土金属差。II A族元素在空气中易被氧化,不但能从稀酸中置换出氢气,而且也能从水中置换出氢气。II B族在干燥空气中常温下不起反应,不能从水中置换出氢气,在稀的盐酸或硫酸中,锌易溶解,镉较难,汞则完全不溶解。
3.化合物的键型及形成配合物的倾向 由于IIB族元素的离子具有18电子构型,因而它们的化合物所表现的共价性,不管在程度上或范围上都比IIA族元素的化合物所表现的共价性为大。IIB族金属离子形成配合物的倾向比IIA族金属离子强得多。
4.氢氧化物的酸碱性 II B族元素的氢氧化物是弱碱性的,且易脱水分解,IIA的氢氧化物则是强碱性的,不易脱水分解。而Be(OH)2和Zn(OH)2都是两性的。
5.盐的溶解度及水解 两族元素的硝酸盐都易溶于水。II B族元素的硫酸盐易溶,而钙、锶、 钡的硫酸盐则是微溶。两族元素的碳酸盐又都难溶于水。
IIB族元素的盐在溶液中都有一定程度的水解,而钙、锶和钡的盐则不水解。
6.某些性质的变比规律 II B族元素的金属活泼性自上而下减弱,但它们的氢氧化物碱性则自上而下增强;而IIA族元素的金属活泼性以及它们的氢氧化物碱性,自上而下一致增强。
四、d区元素
(一)钛副族
1.钛副族元素的基本性质
钛副族元素原子的价电子层结构为(n-1)d2ns2, 所以钛、锆和铪的最稳定氧化态是+4,其次是+3,+2氧化态则比较少见。在个别配位化合物中,钛还可以呈低氧化态0和-l。锆、铪生成低氧化态的趋势比钛小。它们的M(Ⅳ)化合物主要以共价键结合。在水溶液中主要以MO2+形式存在,并且容易水解。由于镧系收缩,铪的离子半径与锆接近,因此它们的化学性质极相似,造成锆和铪分离上的困难。
2.钛的重要化合物
(1)二氧化钛 二氧化钛在自然界以金红石为最重要,不溶于水,也不溶于稀酸,但能溶于热的浓硫酸:
![]()
(2)四氯化钛 四氯化钛是钛的一种重要卤化物,以它为原料,可以制备一系列钛化合物和金属钛。它在水中或潮湿空气中都极易水解将它暴露在空气中会发烟:
TiCl4 + 2H2O=TiO2 + 4HCl
(3)钛(Ⅳ)的配位化台物 钛(Ⅳ)能够与许多配合剂形成配合物,如[TiF6]2-、[TiCl6]2-、[TiO(H2O2)]2+等,其中与H2O2的配合物较重要。利用这个反应可进行钛的比色分析,加入氨水则生成黄色的过氧钛酸H4TiO6沉淀,这是定性检出钛的灵敏方法。
(二)钒副族
1.钒副族元素基本性质
钒副族包括钒、铌、钽三个元素,它们的价电子层结构为(n-1)d3ns2,5个价电子都可以参加成键,因此最高氧化态为+5,相当于d0的结构,为钒族元素最稳定的一种氧化态。按V、Nb、Ta顺序稳定性依次增强,而低氧化态的稳定性依次减弱。铌钽由于半径相近,性质非常相似。
2.钒的重要化合物
(1)五氧化二钒 V2O5可通过加热分解偏钒酸铵或三氯氧化钒的水解而制得:
2NH4VO3 = V2O5 + 2NH3 + H2O
2VOCl3 + 3H2O = V2O5 + 6HCl
在工业上用氯化焙烧法处理钒铅矿,提取五氧化二钒。
V2O5比TiO2具有较强的酸性和较强的氧化性,它主要显酸性,易溶于碱:
V2O5+6NaOH = 2Na3VO4+3H2O
也能溶解在强酸中(PH<1)生成VO2+离子。V2O5是较强的氧化剂:
V2O5 + 6HCl=2VOCl2 + Cl2 + 3H2O
(2)钒酸盐和多钒酸盐 钒酸盐有偏钒酸盐MVO3、正钒酸盐M3VO4和多钒酸盐(M4V2O7、M3V3O9)等。在正钒酸盐的溶液中加入酸,随着pH值逐渐下降,会生成不同聚合度的多钒酸盐:
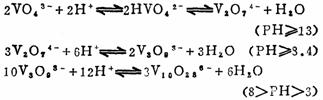
(三)铬副族
1.铬副族的基本性顶
周期系第B族包括铬、钼、钨三个元素。 铬和钼的价电子层结构为(n-1)d5ns1,钨为(n-1)d4ns2。它们的最高氧化态为+6,都具有d区元素多种氧化态的特征。它们的最高氧化态按Cr、Mo、W的顺序稳定性增强,而低氧化态则相反。
2.铬的重要化合物
(1)铬酸、铬酸盐和重铬酸盐
铬酸是强酸,在溶液中存在下列平衡:
![]()
可见向溶液中加酸,平衡向右移动,溶液由黄色变为橙红色,若加碱,平衡向左移动,溶液由橙红色变为黄色。显然离子的相互转化,取决于溶液的pH值。若向溶液中加入Ba2+、Pb2+、Ag+离子等,也能使平衡向左移动,因为这些阳离子的铬酸盐有较小的溶解度。
(2)铬(III)的配位化合物 铬(III)的配合物配位数都是6(少数例外),其单核配合物的空间构型为八面体,Cr3+离子提供6个空轨道,形成六个d2sp3杂化轨道。
3.钼和钨的重要化合物
(1) 钼、钨的氧化物 MoO3、WO3和CrO3不同,它们不溶于水,仅能溶于氨水和强碱溶液生成相应的合氧酸盐。
(2) 钼、钨的含氧酪及其盐 钼酸、钨酸与铬酸不同,它们是难溶酸,酸性、氧化性都较弱,钼和钨的含氧酸盐只有铵、钠、钾、铷、锂、镁、银和铊(I)的盐溶于水,其余的含氧酸盐都难溶于水。氧化性很弱,在酸性溶液中只能用强还原剂才能将它们还原到+3氧化态。
(四)锰副族
1.锰副族的基本性质
ⅦB族包括锰、锝和铼三个元素。其中只有锰及其化合物有很大实用价值。同其他副族元素性质递交的规律一样,从Mn到Re高氧化态趋向稳定。低氧化态则相反,以Mn2+为最稳定。
2.锰的重要化合物
(1)高锰酸钾 高锰酸钟的溶液不十分稳定,在酸性溶液中它明显地分解:
![]()
高锰酸钾的氧化能力和还原产物随溶液的酸度而有所不同。在酸性溶液中,MnO4-是很强的氧化剂,本身被还原为Mn2+如:
![]()
在碱性、中性或微酸性溶液中,高锰酸根被还原为MnO2,如:
![]()
在强碱性溶液中,高锰酸根还原产物是锰酸根MnO42-。
(2)二氧化锰 二氧化锰在中性介质中很稳定,在碱性介质中倾向于转化成锰(Ⅵ)酸盐;在酸性介质中是一个强氧化剂,倾向于转化成Mn2+。
(五)铁系元素
1.铁系元素基本性质
位于第4周期、第一过渡系列的三个iii族元素铁、钴、镍,性质很相似,称为铁系元素。铁、钴、镍三个元素原子的价电子层结构分别是3d64s2、3d74s2、3d84s2,它们的原子半径十分相近,最外层都有两个电子,只是次外层的3d电子数不同,所以它们的性质很相似。铁的最高氧化态为+6,在一般条件下,铁的常见氧化态是+2、+3,只有与很强的氧化剂作用时才生成不稳定的+6氧化态的化合物。钴和镍的最高氧化态为+4,在一般条件下,钴和镍的常见氧化态都是+2。钴的+3氧化态在一般化合物中是不稳定的,而镍的+3氧化态则更少见。
2.化合物的性质(略)