第五章:溶液及气体
(一)1.溶液浓度的表示法及其换算
在一定量的溶液或溶剂中所溶解溶质的量称为溶液的浓度。
溶液浓度可以分为两大类:质量浓度和体积浓度。
质量浓度:
质量百分浓度(%):每100份重的溶液中所含溶质的质量份数。
质量摩尔浓度(m):每1000克重的溶剂中所含溶质的摩尔数。
体积浓度:
体积摩尔浓度(mol.l-1):在1升溶液中所含溶质的摩尔数。
质量浓度不受温度影响,例如,质量摩尔浓度与稀溶液通性有关,用它求摩尔质量较准确。体积浓度虽受温度影响,但影响不大,配制较容易,因此,在化学平衡、化学反应速度中常用体积摩尔浓度。过去在分析化学中常用当量浓度,但现在已不使用。
另外,还有一种浓度表示法称为摩尔分数。摩尔分数(X):某种物质在溶液中的摩尔数与溶液中溶质与溶剂的总摩尔数之比叫该物质的摩尔分数。在稀溶液的通性、蒸气压下降及化学平衡中求分压都使用摩尔分数。
溶液浓度换算主要掌握各种浓度定义,就能方便地进行换算,不必死记硬背公式。
2.稀溶液的通性
所谓稀溶液的通性,是指由于溶质的加入使溶剂本身的一些性质发生变化,如蒸气压下降、沸点上升、凝固点下降。这类性质与溶剂本质有关,与溶质本质无关,仅与溶质的摩尔分数或重量摩尔浓度有关。溶质的分子在溶液中所占的比例越大,即溶液浓度越大,溶液蒸气压下降得越低,沸点上升越高,凝固点下降越低。所以有些教科书中将稀溶液的通性又称为溶液的依数性。
(1)溶液的蒸气压
水蒸气压:在一定温度下,将纯水放在密闭容器中当V蒸发=V凝聚 达到平衡时,在水面上的蒸气压力,称为这个温度时的饱和水蒸气压。
当在水中加入蔗糖等难挥发的非电解质时,由于表面层的水分子一部分被溶质分子占据,单位时间内逸出液面的水分子数目减少,所以在较低蒸气压下就可建立V蒸发=V凝聚的平衡。其结果是溶液的蒸汽压总是低于纯溶剂的蒸气压。
根据拉乌尔定律,在一定温度下,稀溶液的蒸气压下降和溶质的摩尔分数成正比
⊿P=PboxA
可推得 ⊿P=Km
Pbo为纯溶剂的蒸气压,xA为溶质的摩尔分数,K为常数,m为溶液质量摩尔浓度。
上述公式适用于难挥发非电解的稀溶液。
(2)溶液的沸点和凝固点
溶液的沸点上升和凝固点下降的根本原因是由于溶液的蒸气压下降。
沸点,当某一液体的蒸气压等于外界压力时,该液体即沸腾,这时的温度就是该液体的沸点。由于溶液的蒸气压低于纯溶剂的蒸气压,所以只有升高温度,才能使溶液的蒸气压等于外界大气压。同理,某物质的凝固点是固液两相蒸气压相等时的温度。当水和冰在0℃时蒸气压都等于4.6mmHg,所以0℃为水的凝固点。当水中加入蔗糖等非电解质,冰的蒸气压不变,而溶液的蒸气压下降,只有在低于0℃时才能使冰和溶液的蒸气压相等。所以,溶液的沸点上升和凝固点下降的根本原因是溶液蒸气压下降。由于溶液的蒸气压下降与溶液的质量摩尔浓度成正比,所以沸点上升与凝固点下降也与溶液的质量摩尔浓度成正比。总结如下:

上述公式仅适用于非电解质难挥发性物质的稀溶液,Kb为摩尔沸点升高常数,Kf为摩尔凝固点下降常数,其数值与溶剂本质有关。
(3)公式应用
公式用于求凝固点、沸点及溶质分子量。
若有W质克溶质溶于W剂克溶剂中, 已知溶液凝固点下降为⊿Tf,则
![]()
3.溶液渗透压
如果用一种半透膜将溶液和纯溶剂隔开,则产生渗透作用。渗透压大小与溶液浓度有关,范特荷夫综合实验结果,指出了稀溶液的渗透压与温度、浓度的关系。
πV=nRT R为气体常数
或 π=CRT π=mRT
渗透压也是溶液的依数性,渗透压仅与溶液的浓度有关,与溶质的本质无关。
上述公式在生物学上,主要用来求渗透压,而在高分子化学上,则用以求高分子化合物的分子量:
![]()
(二)胶体溶液
1.基本概念:
(1)胶体溶液分散相粒子的大小,介于分子或离子分散体系(即溶液,或称真溶液)及粗分散体系(悬浊液及乳浊液)之间。
(2)胶体中分散相粒子各以一定的界面与周围的介质分开,是多相体系。由于胶体颗粒小、表面积大、表面能大,有聚集成较大的粒子而聚沉的趋势,因此胶体溶液除了分散相和分散介质以外,有时还需加少量的电解质。使胶粒带电荷,以保护胶粒使其不聚沉。
(3)胶体中分散相粒子是由许多分子聚集而成,并带有吸附层及扩散层的胶团结构。
2.胺团结构
胶团结核较为复杂, 以AgI的水溶液为例,若加少量KI,则其结构可表示如下:
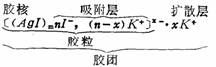
在溶液呻,胶粒是独立运动单位。通常所说胶体粒子带正电或负电仅指胶粒而言。胶体粒子上的电荷是由于胶体粒子对存在于分散介质中的离子的吸附作用所产生,如果胶核优先吸附负离子,它就带负电荷。
胶体离子所所带的电荷,不一定与外加的电解质有关,在通常情况下,它们容易吸附自己结构中所具有的、同时在周围环境中又是较多的那些物质。如用AgNO3及KI制备AgI胶体时反应为:
AgNO3+KI → AgI+KNO3
当KI过量时,AgI便吸附过量的I-离子而带负电荷。反之,当AgNO3过量时,则AgI吸附过量的Ag+而带正电荷。这是由于Ag+和I-离子都和AgI有类似的组成,所以AgI胶粒在不同情况下带有相反的电荷。又如As2S3胶体粒子吸附的是HS-离子,故As2S3胶粒带有负电荷。Al(OH)3是两性胶体,胶粒所带的电荷可以随pH值不同而改变。
3.胶体溶液的性质
(1)动力学性质——布朗运动
由于胶体粒子很小,受到分散剂分子从各个方向撞击力量的不同,溶胶粒子不断地作不规则的布朗运动。
(2)光学性质——丁达尔效应
丁达尔发现,若使一束聚光通过溶胶,则从侧面(即与光束垂直的方向)可以看到一个发光的圆锥体,即为丁达尔效应。这是由胶体颗粒分散度大小决定的。胶体粒子可以使射到它上面的光散射开来,从旁边看出,每个粒子似乎成为一个发光小点。当粒子直径接近1nm时,光在粒子上散射太弱,就不易看到光亮锥。所以有否丁达尔效应是区别胶体与真溶液的最简便方法。高分子溶液由于分散相粒子大小落在胶体分散体系范围内,所以也有丁达尔效应。
(3)电学性质——电泳
由于胶体粒子带电荷,在外加电场作用下,胶体粒子在分散介质中的移动称为电泳。通过电泳实验,可判定胶体粒,子所带的电荷,在生产上可利用电泳原理去除杂质。
4.胶体溶液的稳定性和聚沉作用
胶体溶液能稳定存在,即使在重力场中也不易沉降,这是由于胶体分子小,布朗运动激烈,胶粒表面带有相同的电荷,胶粒之间有一种静电斥力,因而使溶液趋向稳定,即聚集稳定性。由于胶体颗粒小,其体系具有很大的表面积,因而胶体粒子又具有聚集成较大颗级的倾向。胶体聚沉主要是破坏其聚集稳定性。聚沉的方法一般有:
(1)加入电解质:给带电的胶体粒子创造了吸引带相反电荷离子的有利条件,于是胶体粒子的净电荷减少了,或者完全被中和,而胶体粒子间斥力减小,就容易聚成大粒子而沉降下来。
电解质使溶狡聚沉作用的大小,既和电解质浓度有关,也和电解质的离子本性有关,一般规律是:电荷越高,离子(水化离子)半径愈小,聚沉能力越大。使带负电荷胶体聚沉的几种阳离子,按它们的能力大小,可排成下列次序
Al3+>Fe3+>H+>Ca2+>Mg2+>K+>Na+>Li+
使带正电荷的胶体聚沉的几种阴离子,按它们能力大小可排成下列次序:
[Fe (CN)6]4->[Fe (CN)6]3->C rO42->SO42->NO3->Cl-
(2)加入相反电荷溶胶:由于异性相吸,而导致电性中和,使粒子失去聚集稳定性而聚沉。
(3)加热:一可降低胶核吸附电解质的能力,二可增加溶胶颗粒的动能和相互碰撞的机会,其结果必有利于聚沉。
5.气 体
(1).理想气体状态方程式
理想气体的状态方程式表示为
![]()
主要用它来求气体及易挥发性物质的分子量。在一定温度下,测得气体压力P、体积V及重量W,就可根据公式求出气体的分子量。上述公式也可用来计算气体的质量或压力。本方程在化学平衡、 化学动力学、 化学热力学中都有所应用。
在使用本方程时,必须特别注意R的数值及单位,R的值围所用压力和体积的单位不同而改变(详见化学平衡一章)。
2).道尔顿气体分压定律:是讨论混合气体中分压力与总压力的关系,其要点是:
(1)混合气体的总压力等于各组成气体的分压力之和
P总=P1+P2+P3+ .........
所谓分压力,就是指各组成气体在温度不变、单独占据混合气体所占的全部体积时,对器壁施加的压力。总压力就是各组分气体碰撞器壁所产生的压力总和。
(2)各组分气体的分压力等于其摩尔分数乘以总压力:
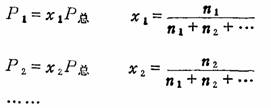
上述公式可由理想气体状态方程推得:
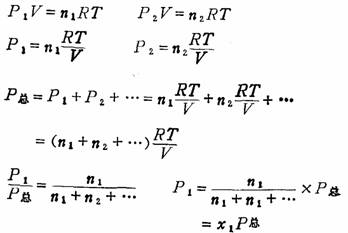
有的书中指出各组分气体的分压力等于体积分数乘以总压力。这里所指的体积分数是指同温同压下某一成分气体的分体积与混合气体的总体积之比。
(3)各组分气体的分压等于其体积分数乘以总压力:
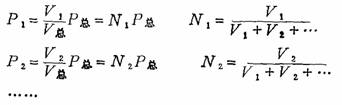
道尔顿分压定律在后面的溶液、化学平衡等章节中都有应用。在溶液一章中的应用主要是气体在水中的溶解度与各气体的分压有关。在有关化学平衡计算中,运用道尔顿分压定律计算各组分气体的分压。在化工生产中经常会遇到气体混合物,利用气体分压定律来研究这些气体混合物也是非常方便的。另外,用排水集气法在水面上收集所得气体,常含有饱和的水蒸气,在这种情况下所读出的压力,是混合气体的压力。