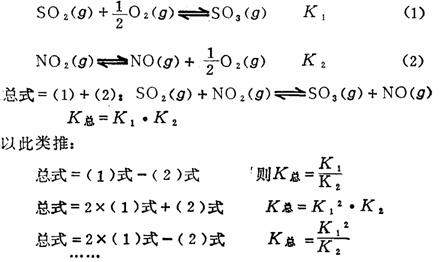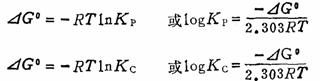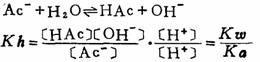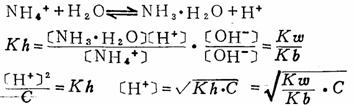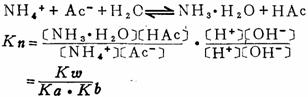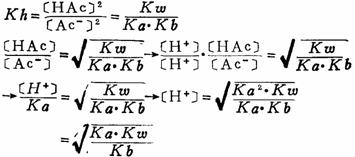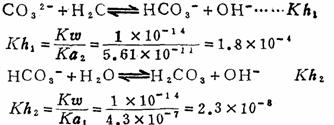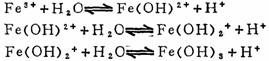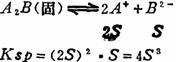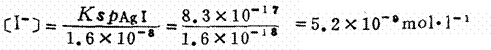第四章:化学平衡 (一)化学平衡状态 当可逆反应进行到V正=V逆时,或从化学热力学的角度当可逆反应进行到它的自由能变化⊿G=0时,称为化学平衡状态。 (二)平衡常数的表示 对于任一可逆反应在一定温度下达到平衡时,Aa+bB
平衡常数可表示为:K=[D]d[E]e/[A]a[B]b 通常溶液中的可逆反应平衡常数用Kc表示,这时各物质的平衡浓度单位用mol/l,气相可逆反应用Kp表示,平衡时各物质的浓度用分压代替。对气相可逆反应Kc与Kp之间的关系为:
⊿n为反应前后气体分子数之差,相当于反应式中的(d+e)-(a+b)。 (三)平衡常数的物理意义 概括起来可以从下列三方面去理解: 1.平衡常数是某一反应的特性常数,它不随物质的初始浓度(或分压)而改变,仅取决于反应的本性。 2.平衡常数的大小标志可逆反应进行的程度。 3.平衡常数表达式表明一定温度下体系达成平衡的条件。 (四)书写平衡常数表达式的要求 1.同一化学反应,由于反应方程式书写不同,是的表达式亦不同,K值亦不同。所以要注意K的表达式与方程式相一致。例如N2O4的分解反应, 可有下列四种形式的方程式表示,相应的Kc有四个,其值各不相同。 N2O4
1/2N2O4
2NO2
NO2
=1/
1. 反应中有固体或纯液体参加,它们的浓度看作是常数,不标在平衡常数表达式中。例如: HgO(s)
Kp=Po21/2 (五)多重平衡规则 例如:下列可逆反应
(六)平衡常数与自由能变化的关系
(七)化学平衡的移动 1.什么叫化学平衡的移动 化学平衡移动是指可逆反应从一种条件下的平衡状态转变到另一种条件下的平衡状态的过程。 2.转化率
3.影响平衡移动的因素 吕查德里原理:(1)浓度 、(2)压力、(3)温度 温度与平衡常数的关系为:
改变浓度和压力能使平衡移动,但不能改变平衡常数K,只有改变温度,平衡常数K才改变。 正、负催化剂对正、逆反应有同样的加速作用或减速作用,它只能缩短或延长达到平衡所需的时间,并不影响化学平衡与平衡常数K。 4.研究平衡移动对国民经济有着重大意义,可提高贵重物质的转化率,降低生产成本,提高经济效应。 (七)电解质溶液 1.强电解质与弱电解质有什么区别? 在水溶液中能完全电离的称为强电解质,仅部分电离的称为弱电解质。 2.什么叫电高度?如何表示? 电离度表示弱电解质在水溶液中电离的程度。
3.什么叫表观电离度?什么叫活度和活度系数? “表观电离度”是反映强电解质(或离子浓度大的)溶液中离子间相互牵制作用的强弱程度。 “活度”是强电解质溶液中离子的理想浓度或热力学浓度,用它来代替真实浓度可以满足质量作用定律。人们常通俗地去理解为单位体积内表观上含有的离子浓度。也就是离子的有效浓度,用符号“a”来表示。它与真实浓度c之间的关系为: a =f·c f 称为活度系数,通常它是小于1的数(在特殊情况下亦可大于1)。当溶液中离子浓度越大,f 值越小,反映离子间相互牵制作用越强;反之离子浓度越小,f 值越接近于1。对弱电解质溶液,忽略离子间的相互作用,即把 f 值作为1,这时不用“活度”而用浓度概念。 (八)一元弱酸、弱碱的电离平衡 1.电离平衡常数 通常用Ki表示,对于弱酸用Ka表示,对于弱碱用Kb表示。 HAc
NH3•H2O
Kb=[ NH4+][ OH-]/[ NH3•H2O
2.Ki的物理意义是什么? 它表示弱电解质分子在水溶液中电离成离子趋势的大小;因此Ki能反映它们酸、碱性的相对强弱程度。 α = [H+]/c = (Ki/c)1/2 这种关系称为稀释定律。 3.影响电离平衡的因素有哪些? (1)温度的影响。Ki与温度有关,但由于弱电解质电离的热效应不大,在较小的温度范围内一般温度变化不影响它的数量级,所以在室温范围内,通常忽略温度的影响。 (2)同离子效应。加入含有相同离子的强电解质会使弱电解质的。减小。 (3)盐效应。加入不含相同离子的强电解质,会使弱电解质的α增大。 4.一元弱酸、弱碱电离平衡体系中[H+]、[OH-]的计算。 (1)一般常用近似解。条件为α<5%,或C/K>380 一元弱酸[H+]的计算公式为
一元弱碱[OH-]的计算公式为
C为弱酸或弱碱的初始浓度。 (2)精确解。当α>5%,或C/Ki<380时; 解法之一,求解一元二次方程。公式为
[H+]与[OH-]亦可用pH值表示,它们的换算关系为pH=-log[H+], pOH=-log[OH-], pH+pOH=14. 解法之二:用逼近法 。 (九)多元弱酸的电离平衡 要记住多元弱酸的电离是分步进行的,以硫氢酸为例: 第一步电离:H2S
第二步电离: HS-
Ka1》Ka2,可见以第一步电离为主,体系中[H+]决定于第一步电离,因此计算公式: 当C/Ka1>380时,[H+]=(Ka1·C)1/2,[S2+]=Ka2 (十)缓冲溶液 1.什么叫缓冲溶液? 能够抵抗外来少量强酸、强碱入侵或被适当稀释而本身pH值基本不变的溶液叫做缓冲溶液。 2.哪些体系具有缓冲能力? 通常下列三类体系具有缓冲能力:①弱酸及其盐,如HAc-NaAc;②弱酸及其盐,如NH3·H2O-NH4Cl; ③多元弱酸的酸式盐及其次级盐。如NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;Na2HPO4-Na3PO4。此外,浓度较高的强酸或强碱亦具有缓冲能力。 3.缓冲溶液的pH如何计算? (1)弱酸及其盐(如HAc-NaAc)体系的计算公式:
(2)弱碱及其盐(如NH3·H2O-NH4Cl)体系的计算公式:
(3)多元弱酸的酸式盐及其次系级盐(如:Na2HPO4-Na3PO4)体系的计算公式:
式中Ka3是磷酸的第三级电离常数。 这里要特别注意的是用多元酸的哪一级电离平衡常数,要视缓冲体系的组成而定,切勿随便乱用。如对NaHCO3-Na2CO3体系,则用碳酸的Ka2。 (十一)盐类水解及其溶液中[H+]、[0H-]的计算 强酸强碱盐不水解,所以其水溶液呈中性。其它各类盐均有程度不同的水解,在计算各类盐水溶液中[H+]、[OH-]时,首先要求出各类盐的水解平衡常数Kh,因为它在手册上是查不到的。 1.弱酸、强碱盐的水解及溶液中[OH-]的计算 例如:NaAc
2.强酸、弱碱盐的水解及溶液中[H+]的计算 例如:NH4Cl
C为盐的浓度 3.弱酸、弱碱盐的水解及[H+]的计算 例如:NH4Ac
由于 [NH4+]=[Ac-], [NH3·H2O]=[HAc],则
4.多元弱酸盐的水解及[H+]、[OH-]的计算 例如 Na2CO3是分步水解
由于Kh1》Kh2,所以[H+]或[OH-]决定于第一步水解。它的[OH-]计算公式即为
C为盐的浓度 5.高价金属离子的水解是分步进行的,而且以第一步水解为主。 例如:
实际上高价Fe3+离子的水解过程是相当复杂的,它们在水溶液中是以多种形式的水合离子存在。可简单地表示为: [Fe(H2O)6]3++H2O
[Fe(H2O)5OH]2+ +H2O
[Fe(H2O)4(OH)2]+ +H2O
(十二)酸碱理论 1. 阿仑尼乌斯的水-离子论 在溶液中能电离出H+离子的物质称为酸,能电离出OH-离子的物质为碱。 H+ + OH -
上述反应称为中和反应。 2.布朗斯特-劳莱的质子论 凡是化学反应中能放出质子(即氢离子)的物质称为酸;接受质子的物质称为碱。它的酸碱关系是共轭关系:
酸、碱反应是质子的转移过程,没有盐的概念。 例如:
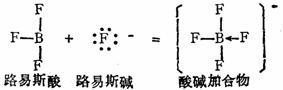
其中 HAc-Ac- 、NH4+-NH3为共轭酸碱对。共轭酸碱的Ka.Kb=Kw。 3.路易斯的广义酸碱理论-电子论 反应中接受电子对的物质称为酸,提供电子对的物质称为碱。
(十三)溶度积概念 例如,难溶电解质AmBn在水溶液中有如下平衡:
根据化学平衡原理,它的平衡常数可表达为 Ksp = [A]m[B]n 式中Ksp称为溶度积常数,简称溶度积。 溶度积常数是温度的函数。它在一定温度下不管溶液中有关离子浓度如何变化,它总是一个常数。因此,溶度积与溶解度之间可以相互换算。 (换算时要注意把溶解度和离子浓度用 mol.1-1单位表示。) 例如:对A2B型难溶盐,其Ksp与溶解度S (mol.1-1的互换关系如下:
难溶盐的Ksp值亦是它溶解度大小的一种标志,但由于它与溶解度的定义不同,所以用它来比较一些难溶盐溶解度大小时,必须要类型相同。如AgCl和Ag2CrO4类型不同,前者为AB型,后者为A2B型。AgCl的Ksp=1.6×10-10>Ag2C rO4的Ksp=l.0×10-12。而它们的溶解度AgCl的S=1.3×10-5mol.l-1<Ag2CrO4的S=6.3×10-5mol.l-1,可见它们的Ksp值大小与S值大小顺序不相一致。 (十四)溶度积规则 溶度积规则是指在难溶盐AmBn的溶液中如果它们离子浓度的乘积(简称离子积)为 [A]m[B]n<KspAmBn时,此溶液为未饱和溶液,无沉淀生成或原有沉淀继续溶解; [A]m[B]n=KspAmBn时,此溶液为饱和溶液,即沉淀与溶解达成平衡; [A]m[B]n>KspAmBn时,为过饱和溶液,有沉淀生成。 利用该规则:(1)可判断体系中有否沉淀生成。(2) 使原有沉淀想法溶解。一般采用生成弱电解质、气体、配合物,或利用氧化还原。其目的同是为了降低有关离子浓度,使其离子积小于相应的Ksp。 (十五)沉淀平衡中的同离子效应及盐效应 同离子效应是指在难溶电解质的溶液中加入含有相同离子的易溶电解质,使得难溶电解质的溶解度降低的效应。盐效应是指加入不含相同离子的易溶电解质,使得难溶电解质溶解度增大的效应。该原理,(特别是同离子效应)常应用于离子分离及沉淀洗涤中。 (十六)分步沉淀与共沉淀 当溶液中同时存在两种或两种以上离子与某一沉淀剂反应而产生沉淀时,离子积先达到其溶度积的难溶盐首先沉淀出来,离子积尚未达到其溶度积的则不沉淀。这就称为分步沉淀。当不断地加入沉淀剂,第一种沉淀越来越多,其相应离子浓度越来越低,而沉淀剂的离子浓度越来越升高,当沉淀剂的离子浓度升高到与溶液中另一种离子浓度的离子积亦达到其溶度积时,则第二种难溶盐亦开始沉淀,这时就称为共沉淀。 例如:在含有0.01mol.l-1Cl-离子和0.01mol.l-1。离子的溶液中逐滴加入AgNO3溶液(体积变化如忽略不计)。已知KspAgCl=1.6×10-10,KspAgI=8.3×10-17,由于AgCl和AgI为同类型难溶盐, 由它们Ksp值的大小可判断AgI的溶解度小于AgCl。所以当在上述溶液中加入AgNO3时,AgI首先达到它的溶度积开始沉淀。此时体系中[Ag+]的浓度为
这时对Cl-离子来说尚未达到其溶度积,所以只有AgI沉淀。这种情况称为分步沉淀。当不断加入AgNO3,AgI不断沉淀出来,[I-]离子浓度不断减小,[Ag+]离子浓度不断增大,当[Ag+]离子浓度增大到
所以AgI沉淀量是微不足道而已。分析化学上常应用该原理进行离子分离。 |