第二十一章 p区金属
(一)硼族元素
1.通性
(1)价电子层结构为ns2np1,氧化态+1,+3。硼、铝、镓、铟四个元素都以+3价为特征,铊由于“ns2惰性电子对效应”则主要表现为+1价。
(2)在硼族元素+3价共价化合物中, 中心原于外层只有6个(3对)电子,仍未满足稳定8电子外层结构,还有一个空轨道,因而这些化合物均有很强的接受电子的趋势,容易与具有孤对电子的分子或离子形成配合物,这个特征被称为“缺电子”特征。以硼的化台物最为明显。
2.硼化合物缺电子特征
(1)BF3易与HF、NH3等加合
(2)H3BO3为一元酸
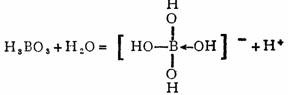
这种酸的离解方式表现了硼化合物的缺电子特征。
(二)P区元素小结
以上我们复习了P区各族元素的性质和电子层结构的关系及其重要化合物的性质。 下面以六大性质:酸碱性、热稳定性、熔沸点、溶解度、水解性及氧化还原来总结P区元素性质递变规律。
1.酸碱性强弱
(1)R-O-H规则:以离子势Φ判别 Φ=离子电荷/离子半径
Φ大,及对O引力大,O电子云密度小,O-H键易断裂,酸性增强。
①同一周期中,不同元素的合氧酸酸性自左至右增强。由于从左至右离子电荷增高,半径变小,Φ增大,所以酸性增强。
②同一主族中,不同元素的含氧酸自上而下酸性逐渐减弱。离子电荷相同,自上而下随着周期数增大,半径增大,Φ变小,所以酸性减弱。
③同一元素形成几种不同氧化数的含氧酸,其酸性随着氧化数的升高而增强。
(2)鲍林规则:配价键多,酸性强。
含氧酸可以写成如下式子:ROm(OH)n,m加大,酸性强。
两种理论发生矛盾时,以配价键多少为主 。
2.热稳定性
碳酸盐加热分解为金属氧化物,放出CO2,金属离子的极化能力强,即对氨的反极化能力强,碳酸盐的热稳定性差。由于Be2+是2电子结构,极化朗力最强,所以BeCO3的分解温度最低。Mg2+——Ba2+离子电荷相同,但离子半径增大,极化能力减小,所以碳酸盐热稳定性增加。
由于H+的反极化能力强,热稳定性顺序为 H2CO3<NaHCO3<Na2CO3
硝酸盐的热分解产物因金属离子不同而不同。

注意:硝酸分解与碳酸盐不同,由于N-O键不牢,加热易断裂,所以硝酸盐分解放出O2,并在高温时有氧化性。
同一成酸元素、不同氧化态的含氧酸及其盐中心离子氧化数高,对O2-的极化能力强,稳定性高, 例如热稳定性变化顺序为
HClO4>HClO3>HClO2>HClO
H2SO4>H2SO3
HNO3>HNO2
3.溶解度 离子化合物的溶解度决定于晶格能及离子的水合能。
① 晶格能大,溶解度小。
Ca(H2PO4)2 CaHPO4 Ca2(PO4)3
易溶 难溶 难溶
阴离子电荷高,晶格能大,溶解度小。
②水合能小,溶解度小。 一般碱金属的盐类易溶于水,仅少数碱金属盐是难溶的。这些难溶盐一般都是由大的阴离子组成,而且碱金属离子越大,难溶盐的数目越多,这是由于当阴阳离子大小相差悬殊时,离子水合作用在溶解过程中占优势。
水合能小,则溶解度小。例如碱金属高氯酸盐溶解度:
N aClO4>KClO4>RbClO4
同理,由于Mg2+到Ba2+半径增大,离子势减小,水合
能减小,则MsSO4到BaSO4的镕解度减小。
②共价成分大,溶解度小。
ZnS CdS HgS 溶解度减小
溶于稀HCl 溶于浓HCl 溶于王水
这是由于Zn2+、Cd2+、Hg2+18电子构型,不仅极化能力强,变形性也强,随着Zn2+、Cd2+、Hg2+半径增大,变形性增大,附加极化效应增大,共价成分增大,溶解度减小。
④聚合程度大,溶解度小。
H3BO3由于氢键联成大片,为固体酸,在冷水中溶解度小,可溶于热水。
NaHCO3的溶解度小于Na2CO3,由于NaHCO3通过氢键而聚合。
4.溶沸点高低
(1)离子化合物晶格能大,熔沸点高。 由于从Li+到Rb+离子半径增大,离子电荷不变,与F-之间引力减弱,晶格能减小,熔沸点降低。
(2)共价成分大,熔沸点低。 由于从Na+到Si4+离子正电荷升高,半径减小,极化能力增大,由离子键向共价键过渡,熔沸点降低。
(3)非极性分子,分子量增大,色散力增大,熔沸点升高。
(4)HF由于形成氢键而缔合,所以熔沸点高。HCl—HBr—HI随着分子量增大,色散力增大,故熔沸点升高。分子间的三种力,以色散力为主。
(5)SiO2为原子晶体,原子间以共价键相结合,结合力大,所以熔沸点高。而CO2是分子晶体,分子间以范德华力结合,结合力小,所以CO2在室温下是气体。
5.盐类的水解
盐类的水解分离子化合物及共价化合物两种情况讨论。
(1)离子化合物的水解
离子化合物水解的实质是弱酸或弱碱盐的离子与水中电离产生的H+或OH-结合,使水解平衡移动。
①阳离子 其共轭碱越弱,水解度越大。 例如:水解度 AsCl3>SbCl3>BiCl3
由于碱性 As(OH)3<Sb(OH)3<Bi(OH)3
②阴离子 其共轭酸越弱,水解度越大。
强硬的阴离子如ClO4-、NO3-等不水解,它们对水pH值无影响,但是弱碱的阴离子如CO32-及SiO42-等明显水解,使溶液pH值增大。
(2)非金属卤化物的水解
①非金属卤化物的水解首先是由水分子以一对孤电子对配位于与卤素结合的元素的原子上,然后排出卤离子和氢离子。
②非金属卤化物能否水解,决定于中心原子的配位数是否已满,若中心原子的配位数已满,水就不能配位上去,不能水解,例如CCl4不水解而SiCl4水解。
③水解类型
BCl3 + 3H2O=H3BO3 + 3HCl
SiCl4 + 4H2O=H2SiO4 + 4HCl
PCl5 + 4H2O=H3PO4 + 5HCl
NCl3 + 3H2O=NH3 + 3HOCl
前三种类型是H2O中OH-离子与中心原子相结合,生成含氧酸。而第四种类型是H+与中心离子相结合,OH-与C1结合生成次氧酸。由于NCl3中N原子周围已有4对电子对,但配位数未满,有一对孤对电子,水分子中的氢原于有空的轨道,所以与N的孤电子对结合,发生水解作用。
(3)防止水解及水解的应用。
①配制溶液时,常因水解生成沉淀,为了防止水解,需加相应酸。如 SnCl2+H2O=Sn(OH)C14+HCl
在上式反应中加HCl可使水解平衡向左移动,防止沉淀产生。
②制备无水盐,需考虑水解。如 ZnCl2·H2O = Zn(OH)C1+HCl
在上述反应中,蒸发脱水时由于温度升高,水解度增大,不能得到无水盐,只能得到水解产物。只有在氯化氢气氛中蒸发,才能得到无水盐。
6.氧化还原性
(1)含氧酸及其盐的氧化还原性
①含氧酸的氧化还原性与其氧化数有关,氧化数最高的含氧酸仅显氧化性,如HNO3、浓H2SO4。 氧化数处于中间状态,既显氧化性又显还原性,如HNO2、H2SO3。成酸元素氧化态处于最低时仅显还原性,如NH3、H2S。
②在同一周期中,各元素最高氧化态含氧酸的氧化性从左到右增强,例如H2SiO4和H3PO4几乎无氧化性,H2SO4只有在高温和浓度大时表现强氧化性,而HClO4是强氧化剂。
③氧化还原性与稳定性有关,同一元素不同价态的含氧酸越稳定,其氧化性就越弱,反之稳定性越差、氧化性越强。
④溶液的pH值对含氧酸及其盐的氧化还原性影响很大。同一物质在不同pH值条件下,其氧化还原强度不同,含氧酸盐在酸性介质中的氧化性比在中性或碱性介质中强,含氧酸盐作还原剂时,在碱性介质中还原性比酸性介质中强。
(2)非金属单质的氧化还原性
① B、Si在碱性溶液中与H2O作用放出H2气。
②C、N、O与H2O不反应。
③F2与H2O作用放出O2气。
④P、S、C12、Br2、I2与碱作用发生歧化反应。
(七)P区元素氢化物的性质递变规律
1.稳定性
对于同一族元素从上到下、对于同一周期元素从右到左电负性减小,与氢结合能力减弱,稳定性减弱。以氮族氢化物为例,NH3很稳定,PH3加热则分解为其组成元素。AsH3和SbH3在室温时逐渐自动分解,BiH3很容易分解。
2.还原性
除了HF外,其它分子型氢化物都有还原性。氢化物HnA的还原性来自An-,而且An-失电子能力和其半径及电负性大小有关。在周期表中,从上到下、从右到左,An-的半径增大,电负性减小,An-失电子能力依上述方向递增,所以氢化物还原性也按此方向递增。以第三周期氢化物为例,SiH4与PH3、空气或氧接触即自动燃烧,H2S需加热才能在氧中燃HCl需加热加催化剂才能与氧作用。
3.酸碱性
按质子理论,物质为酸或碱,是与它能否给出和接受质子有关,而酸碱强度又与给出质子和接受质子的难易程度有关。碳族元素的氢化物既不给出质子又不接受质子,无所谓酸碱性。氮族元素的氢化物接受质子的倾向大于给出质子的倾向,所以它们是碱。而氧族元素及卤素的氢化物大部分是酸,个别的如H2O既是酸又是碱。