第二十章s区元素(碱金属与碱土金属)
(一)通性
1.它们的价电子构型为ns1-2, 内层为稀有气体稳定电子层结构。价电子很易失去呈+1、+2氧化态。都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2.有较大的原子半径。因为每一周期是从碱金属开始建立新的电子层。原子半径变化的规律:同周期从IA到IIA减小,同族中从上到下增大。
3.电离势和电负性均较小,其变化规律为同周期从IA到IIA增大,同族中从上到下顺序减小。
(二)物理性质
单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。它们在密度、 熔点、沸点和硬度方面往往差别较大。
(三)化学性质
1.它们具有很高的化学活泼性,能直接或间接地与电负性较高的非金属元素形成相应的化台物。如可与卤素、硫、氧、磷、氮和氢等元素相化合。一般均形成离子化台物(除Li、Be及Mg的卤化物外)。
2.单质与水反应放出氢气。其中Be和Mg由于表面形成致密的氧化膜因而对水稳定。
3.标准电极电势均很负,是很强的还原剂。它们的还原性在于态及有机反应中有广泛的应用。如高温下Na、Mg、Ca能把其它一些金属从氧化物或氯化物中还原出来.
4.单质制备
由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。单质的制备多数采用电解它们的熔盐。
(四)氧化物和氢氧化物
1.碱金属的氧化物比碱土金属的氧化物种类多。它除有正常氧化物外,还有过氧化物、超氧化物及臭氧化物。
如碱金属在空气中燃烧时,只有Li的主要产物是Li2O(正常氧化物),而Na、K、Rb、Cs的主要产物分别是Na2O2(过氧化物)、KO2(超氧化物)、 RbO2(超氧化物)和Cs2O2(过氧化物)。
2.氢氧化物除Be(OH)2呈两性外,其余均为中强碱或强碱。
(五)盐 类
1.碱金属的盐类
有MX(卤化物)、MNO3、M2SO4、M2CO3、M3PO4等。它们的共性如下:
①都是离子晶体(Li盐除外);
②都易溶解。除Li盐和极少数大阴离子组成的盐以外,例如LiF、Li2CO3、Li3PO4、 Na[Sb(OH)6]、NaZn(UO2)3(CH3COO)9·6H2O等均难溶。
③热稳定性均很高,但Li 2CO3和硝酸盐除外,它们加热会分解:
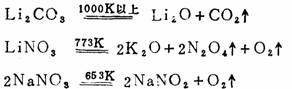
④易形成复盐。
光卤石类通式: M+Cl·MgCl2·6H2O (M+=K+,Rb+,Cs+)
矾类通式: M2+SO4·MgSO4·6H2O (M+=K+,Rb+,Cs+)
2.碱土金属盐类
![]() 其溶解度与碱金属盐有些差别。它们的碳酸盐、磷酸盐和草酸盐均难溶。BaSO4、BaCrO4的溶解度亦很小。
其溶解度与碱金属盐有些差别。它们的碳酸盐、磷酸盐和草酸盐均难溶。BaSO4、BaCrO4的溶解度亦很小。
它们的碳酸盐在常温下均较稳定(BeCO3例外),但加热可分解:
热稳定性由Mg到Ba顺序增强。