第二章:分子结构及化学键 (一)化学键 通常把分子(或晶体)中直接相邻的两原子间的强烈作用力称为化学键。 1.离子键 当电负性小的活泼金属原子与电负性大的活泼非金属原子相遇时,由于原子间发生电子转移形成正、负离子,并通过静电作用而形成的化学键叫做离子键。 (1)离子键的本质是静电作用力,没有方向性和饱和性。 (2)离子的特征,即离子的电荷、离子的半径和离子的电子层构型。 (3)离子的电子层构型有以下几种: 2电子构型:如Li+、Be2+等。 8电子构型:如N a+、Ca2+及一些简单阴离子Cl-、O2+等。 18电子构型:如Zn 2+、Hg2+、Cu+、Ag+等。 18+2电子构型:即次外层18+最外层2,如P2+,Sn2+ 等。 9~17不规则构型:如Fe2+,Cr3+,Mn2+等。
U可根据热力学有关数据,利用波恩-哈伯循环进行计算, 2.共价键 由原子形成分子时不是靠电子转移,而是通过原子间 共用电子对来实现。由这种共用电子对结合而成的化学键称为共价键。共价键理论有电子配对理论、杂化轨道理论、价层电子对互斥理论以及近代发展起来的分子轨道理论。 (1)电子配对理论 ①其要点为成键的两原子中要有单电子而且自旋必须相反,两原子轨道要发生最大程度的重叠。 ②共价键的特性是具有方向性和饱和性。 ③共价键的键型有σ键和π键。 σ键的特点是两个原子轨道沿键轴方向以“头碰头”的方式重叠,重叠部分沿着键轴呈圆柱形对称。这种方式重叠程度大,所以口键的键能大,稳定性高。 π键的特点是两个原子轨道以平行即“肩并肩”方式重叠,重叠部分对通过一个键轴的平面呈镜面反对称。它的重叠程度较小,所以稳定性较差。 (2)杂化轨道理论 其要点是在形成分子时,由于原子的相互影响,能量相近的不同类型的原子轨道混合起来,重新组成一组能量等同的新的杂化轨道,杂化轨道的数目与组成杂化轨道的各原子轨道的数目相等;杂化轨道又分为等性和不等性杂化两种;杂化轨道成键时要求轨道最大重叠,键与键之间斥力最小。
(3)价层电子对互斥理论 分子的构型主要取决于中心原于价电子层中电子对(包括成键电子对和孤电子对)的互相排斥作用。而分子的构型总是采取电子对之间的斥力最小的那种。 ①如果中心原子价层电子对全是成键电子对,则判断构型十分简单。
②如果中心原子价层电子对中含有孤电子对,则每个孤电子对占有相当一个单键电子对的位置(对等同的单键位置,可任意选取,对不等同的单键则要按电子对之间斥力最小的原则选取。如三角双锥形中,孤电子对只允许占据平面三角形中任意单键位置)。 ③如果分子中有双键或叁键,则电子对互斥理论仍适用,把重键视作一个单键看待。如CO2分子为直线型O=C=O。 ④价电子对之间的斥力大小,决定于电子对之间的夹角和电子对的成键情况。电子对之间的夹角越小,斥力越大。电子对之间斥力的大小顺序为孤电子对-孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对-成键电子对之间的斥力。 ⑤中心原子价电子层电子对数的计数,即中心原子的价电子数加配体供给的电子数之和被2除。而氧族原子作为配体时可认为不提供共用电子(如PO43+ 的中心原子P,价电子5个,加上电荷数3个,共8个电子,即4对价电子对) ,但当氧族原子作为中心原子时,可认为它提供6个价电子(如SO3的中心原于S提供6个价电子,氧作为配体不提供电子,所以中心原子S的价电子对为3对)。如果讨论的物质是阳离子,如NH4+,中心原子N价电子2s22p3共5个加上四个配体各提供一个电子,减去一个电荷共8个电子,即4对价电子。 (4)分子轨道理论 电子配对理论、杂化轨道理论和价层电子对互斥理论比较直观,能较好地说明共价键的形成和分子的空间构型,但也有一定的局限性,如不能解释单电子键、三电子键和磁性等问题,而分子轨道理论能给于比较好的说明。 ①分子轨道理论的要点 a.分子中的电子不从属于某个特定的原子,而是从属于整个分子。 b.分子轨道是由原子轨道线性组合而成,组成的分子轨道数目与参加组合的原子轨道数相同。 c.每个分子轨道有它相应的能量与图象。根据分子轨道曲对称性不同,可分为σ分子轨道和π分子轨道。 d.在分子轨道中排布电子时同样遵循保里原理、能量最低原理和洪特规则。 ②原子轨道组合的原则有三点,即能量近似、最大重叠和对称匹配。 ③原子轨道组合的类型: 有s-s组合;s-p组合,p-p组合;p-d组合;d-d组合。 例如两个Ψ1s原子轨道组合成两个分子轨道可以表示为
Ψ1为成键分子轨道,常用σl s表示。Ψ2为反键分子轨道,常用σls*表示。 ④同核双原子分子的分子轨道能级图 N2、C2、B2等分子的轨道能级顺序为
O2,F2 分子轨道能级顺序为
(5)键参数 键参数为表征价键性质的某些物理量,如键级、键能、键角、键长、键的极性等数据。 ①键级=(成键电子数-反键电子数)/2 ②键能:对AB型双原子分子而言, 键能为离解能D。 对多原子分子而言,键能为多个键的平均离解能,如:NH3分子的N-H键能
③键长:即分子中两个原子核间的平衡距离。 ④键角:即分子中键和键之间的夹角。 ⑤键的极性:共价键分为非极性共价键和极性共价键两种,可用参与成键的两个原子的电负性差来衡量。电负性差大于1.7时,可以认为是离子键;电负性差介于1.7到0之间,可以认为是极性共价键;电负性差等于零,为非极性共价键。 3.金属键 金属键理论有改性共价键理论及能带理论。 (1)改性共价键理论认为金属键是由金属原子共用能够流动的自由电子所组成的。 (2)能带理论(省略) 4.配位共价锭(在配合物一章中复习) (二)晶体类型及其物理性质 晶体可分为:1.离子晶体;2.分子晶体;3.原子晶体; 4.金属晶体;5.混合晶体 1.离子晶体 离子化台物的晶体属离子晶体,如NaCl、CsCl等。在离子晶体中,晶格结点上的质点是正、负离子,质点间的作用力是静电引力。晶体的特点是有较高的熔、沸点和硬度,但较脆,延展性差,在熔融状态或在水溶液中能导电。 2.分子晶体 如CO2,HCl,I2等,在分子晶体中,晶格结点上的质点是分子(包括极性或非极性的),质点间的作用力是范德华引力。分子内原子间是共价键。因此晶体的熔、沸点较低,硬度较小,固体不导电,熔化时一般也不导电。只有极性很强的分子晶体(如HCl)溶解在水中,由于电离而导电。 3.原子晶体 如金刚石(C)、Si、B、SiO2、SiC、BN等,在晶体的晶格结点上的质点是原子,原子间是通过共价键相联结。因此它的熔、沸点高,硬度大,不导电,不导热,但Si、SiC具有半导体性质。 4.金属晶体 晶体中晶格结点上的质点是金属原子或金属离子,结合力是金属键(自由电子),它的特点是具有较大的比重,有金属光泽,能导电、导热,有良好的延展性等。 5.混合晶体 如石墨、石棉、云母等晶体,在它们的晶体中具有多种作用力。 以石墨为例,层内质点问(即C原子之间)以共价键相结合,同时还具有可自由流动的:电子 (相当于金属键),层间靠范德华引力相联结。因此它具有光泽,能导电、导热,容易滑动。 (三)分子间作用力及氢键 1.分子可分为极性分子和非极性分子。极性分子:分子中正、负电荷重心不相重合;非极性分子:分子中正、负电荷重心相重合。 分子的极性大小用偶极矩µ衡量,µ=o。为非极性分子,µ越大,分子的极性越强。 µ=q.L q是偶极一端上的电荷。 L是分子的偶极距离。 2.分子间的作用力即范德华力,它比化学键键能小一、二个数量级。它包括:①取向力:永久偶极间的相互作用力。②诱导力:诱导偶极同永久偶极间的作用力。③色散力:由于瞬间偶极而产生的相互作用力。 3.氢键,它的键能与分子间力相近。 氢键通常可表示为X—H……Y,X、Y代表F、O、N等电负性大而原子半径小的原子。X与Y可以是相同元素,也可以是不同元素。 氢键有方向性与饱和性,它可分为两类: ① 分子间氢键:如H2O分子之间的氢键
② 分子内氢键:如 邻硝基苯酚分子内的氢键:
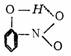
(四)离子的极化作用 离子间除了静电引力外,诱导力亦起看很重要的作用,因为阳离子有多余的正电荷,半径又较小,壳层上缺少电子,因此它对相邻的阳离子会起诱导作用,这种作用称为离子的极化作用;阴离子半径较大,在壳层上有较多的电子,因此在被诱导过程中容易变形而产生诱导偶极,这种现象称为离子的变形性。阴离子产生的诱导偶极又会反过来诱导阳离子,阳离子如果变形也会产生偶极,这样使正、负离子之间产生了额外的作用力。 1. 决定离子极化作用大小的因素 (1)离子的电荷,电荷高,极化作用大; (2)离子的半径,半径小,极化作用大; (3)离子的价层电子结构: (2电子、18电子或18+2电子构型)>(9~17不规则构型)>(8电子构型) 2.决定变形性大小的因素 (1)电荷:正电荷越低,负电荷越高,变形性越大, 如:O2->F->N e>N a+>Mg2+>Al3+>Si4+。 (2)半径:半径越大,变形性越大。 I->Br->Cl->F- (3)价层电子的结构:(18电子和9~l 7不规则构型>>(8电子构型)。 复杂离子的极化作用与变形性通常都较小。 3.离子的极化作用对化合物性质的影响 (1)使离子键向共价键型过渡; (2)使化合物的溶解度减小; (3)使化合物的颜色加深。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||