第十五章 氧族元素
1.通性
(1)价电子层结构ns2np4,氧化态-2、+2、+4、+6,氧仅显-2价(除H2O2及OF2外)。
(2)氧族元素原子最外层6个电子,因而它们是非金属(钋除外),但不及卤素活泼。
(3)随着原子序数增大,非金属性减弱,氧硫是非金属、硒、碲是半金属,钋是典型金属。氧的电负性最高,仅次于氟,所以性质非常活泼,与卤族元素较为相似。
2.过氧化氢
制备:电解60%H2SO4溶液,减压蒸馏得H2S2O8,水解可得H2O2。
H2S2O8+2H2O=2H2SO4+H2O2↑
性质:(1)不稳定性:H2O2=H2O + 1/2O2
光照及少量金属离子存在都能促进分解。
(2)氧化还原性:由于H2O2氧化数处于中间,所以既显氧化性又显还原性,以氧化性为主。
(3)弱酸性:H2O2+Ba(OH)2=BaO2+2H2O
(1)硫化氢
制备: FeS + 2HCl=FeCl2 + H2S
H2S是一种有毒气体,需在通风橱中制备。实验室中以硫代乙酰胺水解产生H2S。
CH3CSNH2 + 2H2O=CH3COONH4 + H2S
性质:①还原性。硫化氢水溶液不能长久保存,可被空气中的氧气氧化析出S。
②沉淀剂。由于大多数金属硫化物不溶于水,在定性分析中,以H2S作为分离溶液中阳离子的沉淀剂。
检验:以Pb(Ac)2试纸检验,H2S使试纸变黑:
H2S+Pd(Ac)2=PdS+2HAC
(2)硫化物
为什么大多数金属硫化物难溶于水,从结构观点来看,由于S2-变形性大,如果阳离子的外电子构型是18、18+2或8~18电子构型,由于它们的极化能力大,变形性也大,与硫离子间有强烈的相互极化作用,由离子键向共价键过渡,因而生成难溶的有色硫化物。
4.硫酸
浓H2SO4与稀H2SO4氧化性不同。在稀H2SO4,显氧化性的主要是H+。
浓H2SO4是强氧化剂,其中显氧化作用的是S6+,它可以氧化其他物质,而本身被还原成低氧化数的SO2、S、H2S等等
5,亚硫酸及其盐
性质:(1)不稳定性; (2)由于S4+氧化数处于中间,既显还原性,又显氧化性,以还原性为主。配制Na2SO3溶液必须随配随用,放置过久则失效。(3)Na2SO3与S作用。
第十六章 氮 磷 砷
1. 通性
(1)价电子层结构为ns2np3,主要氧化态为-3、+3、+5。
(2)氮族元素得电子趋势较小,显负价较为困难。因此氮族元素的氢化物除NH3外都不稳定,而氧化物均较稳定。
(3)由于从As到Bi,随着原子量的增加,ns2惰性电子对的稳定性增加。
2.氨和铵盐
(1)NH3具有还原性:
![]()
(2)配合性:由于,NH3上有孤对电子 Ag+十2NH3=[Ag(NH3)2]+
(3)NH4+与K+电荷相同、半径相似,一般铵盐性质也类似于钾盐。它们的盐类同晶,并有相似的溶解度。
3. 硝酸及硝酸盐
(1)HNO3是强氧化剂,许多非金属都易被其氧化为相应的酸,而HNO3的还原产物一般为NO。
HNO3几乎溶解所有的金属(除Au、P外),HNO3的还原产物决定于HNO3浓度及金属的活泼性。浓HNO3一般被还原为NO2,稀HNO3还原产物为NO,活泼金属如Zn、Mg与稀HNO3还原产物为H2O,极稀HNO3的还原产物为NH4+。
(2)硝酸盐较硝酸稳定,氧化性差,只有在酸性介质及焰部态才显氧化性。
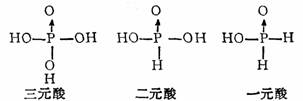
4.磷的含氧酸
(1)磷在充足的空气中燃烧生成P4O10,这是由P4四面体结构所决定。磷酐与水作用先形成偏磷酸,然后是焦磷酸,最后得到正磷酸。都是以磷氧四面体为结构基础。
(2)H3PO4、H3PO3、H3PO2都以磷氧四面体结构为特征。
第十七章 碳 硅 硼
1.通性
(1)价电子结构为ns2np2,氧化态+2、+4。
(2)以Ge到Pb,ns2惰性电子对稳定性增强。
2.碳酸及碳酸盐
(1)CO2溶于水存在平衡,大部分以CO2.H2O的形式存在,只有少部分形成H2CO3,与SO2溶于水的情况相似。
(2)碳酸盐水解
由于碳酸是很弱的酸,所以碳酸铂在溶液中水解呈较强的碱性,称为纯碱。
(3)Na2CO3溶液中加入金属离子,生成何种沉淀,根据碳酸盐及氢氧化物溶解度大小来决定。
①金属氢氧化物溶解度小于碳酸盐溶解度,则生成氢氧化物沉淀,如Fe(III)、AI(III)、Cr(III)。
②金属氢氧化物溶解度相近于碳酸盐的溶解度,则得到碱式碳酸盐沉淀,如Bi(III)、Hg(II)、Cu(II)、Mg(II)。
③金属碳酸盐的溶解度小于氢氧化物溶解度,则得到碳酸正盐沉淀,如Ba(II)、Ca(II)、Cd(II)、Mn(II)、Pb(II)。
3.硅酸及硅酸盐
(1)硅酸:在实验室中,用盐酸与可溶性硅酸盐作用可得硅酸,硅酸是很弱的酸,在水中溶解度小。在水中随条件不同,逐步聚合成硅酸凝胶。
(2)由于硅酸很弱,N a2SiO3在溶液中强烈水解呈碱性
(3)鉴定SiO32-:在SiO32-溶液中加入NH4Cl,发生完全水解,且有H2SiO3沉淀生成并放出NH3。