第十章 沉淀平衡
(一)溶度积概念
例如,难溶电解质AmBn在水溶液中有如下平衡:
![]()
根据化学平衡原理,它的平衡常数可表达为 Ksp = [A]m[B]n
式中Ksp称为溶度积常数,简称溶度积。
溶度积常数是温度的函数。它在一定温度下不管溶液中有关离子浓度如何变化,它总是一个常数。因此,溶度积与溶解度之间可以相互换算。 (换算时要注意把溶解度和离子浓度用 mol.1-1单位表示。)
例如:对A2B型难溶盐,其Ksp与溶解度S (mol.1-1的互换关系如下:
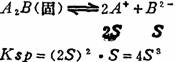
难溶盐的Ksp值亦是它溶解度大小的一种标志,但由于它与溶解度的定义不同,所以用它来比较一些难溶盐溶解度大小时,必须要类型相同。如AgCl和Ag2CrO4类型不同,前者为AB型,后者为A2B型。AgCl的Ksp=1.6×10-10>Ag2C rO4的Ksp=l.0×10-12。而它们的溶解度AgCl的S=1.3×10-5mol.l-1<Ag2CrO4的S=6.3×10-5mol.l-1,可见它们的Ksp值大小与S值大小顺序不相一致。
(二)溶度积规则
溶度积规则是指在难溶盐AmBn的溶液中如果它们离子浓度的乘积(简称离子积)为
[A]m[B]n<KspAmBn时,此溶液为未饱和溶液,无沉淀生成或原有沉淀继续溶解;
[A]m[B]n=KspAmBn时,此溶液为饱和溶液,即沉淀与溶解达成平衡;
[A]m[B]n>KspAmBn时,为过饱和溶液,有沉淀生成。
利用该规则:(1)可判断体系中有否沉淀生成。(2) 使原有沉淀想法溶解。一般采用生成弱电解质、气体、配合物,或利用氧化还原。其目的同是为了降低有关离子浓度,使其离子积小于相应的Ksp。
(三)沉淀平衡中的同离子效应及盐效应
同离子效应是指在难溶电解质的溶液中加入含有相同离子的易溶电解质,使得难溶电解质的溶解度降低的效应。盐效应是指加入不含相同离子的易溶电解质,使得难溶电解质溶解度增大的效应。该原理,(特别是同离子效应)常应用于离子分离及沉淀洗涤中。
(四)分步沉淀与共沉淀
当溶液中同时存在两种或两种以上离子与某一沉淀剂反应而产生沉淀时,离子积先达到其溶度积的难溶盐首先沉淀出来,离子积尚未达到其溶度积的则不沉淀。这就称为分步沉淀。当不断地加入沉淀剂,第一种沉淀越来越多,其相应离子浓度越来越低,而沉淀剂的离子浓度越来越升高,当沉淀剂的离子浓度升高到与溶液中另一种离子浓度的离子积亦达到其溶度积时,则第二种难溶盐亦开始沉淀,这时就称为共沉淀。
例如:在含有0.01mol.l-1Cl-离子和0.01mol.l-1。离子的溶液中逐滴加入AgNO3溶液(体积变化如忽略不计)。已知KspAgCl=1.6×10-10,KspAgI=8.3×10-17,由于AgCl和AgI为同类型难溶盐, 由它们Ksp值的大小可判断AgI的溶解度小于AgCl。所以当在上述溶液中加入AgNO3时,AgI首先达到它的溶度积开始沉淀。此时体系中[Ag+]的浓度为
![]()
这时对Cl-离子来说尚未达到其溶度积,所以只有AgI沉淀。这种情况称为分步沉淀。当不断加入AgNO3,AgI不断沉淀出来,[I-]离子浓度不断减小,[Ag+]离子浓度不断增大,当[Ag+]离子浓度增大到
![]()
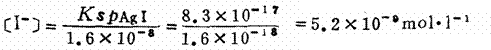 此时[Ag+]离子浓度既满足[Ag+][Cl-]=KspAgCl,又满足[Ag+][I-]=KspAgI。故体系中不仅有AgI沉淀产生,而且AgCl亦开始沉淀。这种情况称为共沉淀。不过此时因为[I-]离子浓度已很小:
此时[Ag+]离子浓度既满足[Ag+][Cl-]=KspAgCl,又满足[Ag+][I-]=KspAgI。故体系中不仅有AgI沉淀产生,而且AgCl亦开始沉淀。这种情况称为共沉淀。不过此时因为[I-]离子浓度已很小:
所以AgI沉淀量是微不足道而已。分析化学上常应用该原理进行离子分离。